IPC分类号 : C07C247/10,C07C45/68,C07C315/04,C07D313/00,C07D337/00,C07D225/08,C07D249/06,A61P35/00
专利摘要
本发明公开了一种中环化合物及其制备方法和应用,该中环化合物的结构式为:上述中环化合物,包括三个并联环的基本结构,并在基本结构上取代有R1、R2、X、A等功能性基团。经细胞实验表明,该中环化合物可以有效抑制肿瘤的生长,可用作抗肿瘤的药物。
权利要求
1.一种中环化合物,其特征在于,结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,
R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,
-R’为H或C1~C5的烷基,
-X-为含C、O、N、S或P的基团,
-A为-CF3、-N3、-PO(R3)2、 或-C4F9,其中,R3为C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R4为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,
R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,
n为-1~20之间的整数,m为0、1、2或3。
2.根据权利要求1所述的中环化合物,其特征在于,-X-为-CH2-、-NH-、-O-、-PH3-、-S-、-SO2-、-NTs-、-OCH2CH2CH=CH-或-CHCH3-。
3.根据权利要求1所述的中环化合物,其特征在于,-R’为H。
4.根据权利要求1所述的中环化合物,其特征在于,R1为H,R2为H或卤素,-R’为H,R1所取代的环为苯环,R2所取代的环为苯环,-X-为-CH2-,m为0,n为0~5之间的整数。
5.一种如权利要求1~4中任一项所述的中环化合物的制备方法,其特征在于,包括如下步骤:
提供化合物A和化合物B,其中,所述化合物A的结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,-R’为H或C1~C5的烷基,-X-为含C、O、N、S或P的基团,R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,n为-1~20之间的整数,m为0、1、2或3;所述化合物B为能够与化合物A发生闭环反应并提供功能性基团-A的化合物;以及
在惰性气体氛围中,按摩尔比1:20~20:1将所述化合物A和所述化合物B溶于第一溶剂中,于20℃~120℃下反应,得到中环化合物,所述中环化合物的结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,-R’为H或C1~C5的烷基,-X-为含C、O、N、S或P的基团,-A为-CF3、-N3、-PO(R3)2、 或-C4F9,其中,R3为C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R4为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,n为-1~20之间的整数,m为0、1、2或3。
6.根据权利要求5所述的中环化合物的制备方法,其特征在于,所述化合物B的结构式为:
其中,-A’为-CF3或-N3;-A”为-CF3或-N3。
7.根据权利要求5所述的中环化合物的制备方法,其特征在于,所述化合物B的结构式为:
其中,R3为C1~C20的烷基、C6~C20芳基或C1~C20的烷氧基。
8.根据权利要求5所述的中环化合物的制备方法,其特征在于,所述化合物B的结构式为:
其中,R4为C1~C20的烷基,C6~C20的芳基或C1~C20的烷氧基。
9.根据权利要求5所述的中环化合物的制备方法,其特征在于,所述化合物B的结构式为:
或者C4F9SO2R6
其中,R5为卤素,R6为卤素。
10.如权利要求1~4任一项所述的中环化合物在制备抗肿瘤药物中的应用。
说明书
技术领域
本发明涉及有机化学技术领域,特别是涉及一种中环化合物及其制备方法和应用。
背景技术
近年来,全球肿瘤发病数逐年递增,肿瘤对人类健康和生命的威胁很大,它和心血管疾患已成为医学上的两大难关,在全世界构成死亡原因的前两位。
然而,目前还缺乏治疗肿瘤的有效药物。
发明内容
基于此,有必要提供一种可用于治疗肿瘤的中环化合物及其制备方法和应用。
一种中环化合物,结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,
R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,
-R’为H或C1~C5的烷基,
-X-为含C、O、N、S或P的基团,
-A为-CF3、-N3、-PO(R3)2、 或-C4F9,其中,R3为C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R4为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,
R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,
n为-1~20之间的整数,m为0、1、2或3。
在一个实施方式中,-X-为-CH2-、-NH-、-O-、-PH3-、-S-、-SO2-、-NTs-、-OCH2CH2CH=CH-或-CHCH3-。
在一个实施方式中,-R’为H。
在一个实施方式中,R1为H,R2为H或卤素,-R’为H,R1所取代的环为苯环,R2所取代的环为苯环,-X-为-CH2-,m为0,n为0~5之间的整数。
一种上述的中环化合物的制备方法,包括如下步骤:
提供化合物A和化合物B,其中,所述化合物A的结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,-R’为H或C1~C5的烷基,-X-为含C、O、N、S或P的基团,R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,n为-1~20之间的整数,m为0、1、2或3;所述化合物B为能够与化合物A发生闭环反应并提供功能性基团-A的化合物;以及
在惰性气体氛围中,按摩尔比1:20~20:1将所述化合物A和所述化合物B溶于第一溶剂中,于20℃~120℃下反应,得到中环化合物,所述中环化合物的结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,-R’为H或C1~C5的烷基,-X-为含C、O、N、S或P的基团,-A为-CF3、-N3、-PO(R3)2、 或-C4F9,其中,R3为C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R4为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,n为-1~20之间的整数,m为0、1、2或3。
在一个实施方式中,所述化合物B的结构式为:
或者
其中,-A’为-CF3或-N3;-A”为-CF3或-N3。
在一个实施方式中,所述化合物B的结构式为:
其中,R3为C1~C20的烷基、C6~C20芳基或C1~C20的烷氧基。
在一个实施方式中,所述化合物B的结构式为:
其中,R4为C1~C20的烷基,C6~C20的芳基或C1~C20的烷氧基。
在一个实施方式中,所述化合物B的结构式为:
或者C4F9SO2R6
其中,R5为卤素,R6为卤素。
上述的中环化合物在制备抗肿瘤药物中的应用。
上述中环化合物,包括三个并联环的基本结构,并在基本结构上取代有R1、R2、-X-、-A等功能性基团。该中环化合物可以由手性底物得到手性转移的产物,经细胞实验表明,该中环化合物可以有效抑制肿瘤的生长,可用作抗肿瘤的药物。
附图说明
图1为一实施方式中环化合物的制备方法的流程图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
一实施方式的中环化合物,结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,-R’为H或C1~C5的烷基,-X-为含C、O、N、S或P的基团,-A为-CF3、-N3、-PO(R3)2、 或-C4F9,其中,R3为C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R4为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,n为-1~20之间的整数,m为0、1、2或3。
具体的,R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷。在一个实施方式中,R1所取代的环为苯环,R2所取代的环也为苯环时,中环化合物,结构式为:
在另一个实施方式中,当R1所取代的环为环己烷,R2所取代的环也为环己烷时,中环化合物,结构式为:
具体的,n=-1时,表示括号内的-CH2为数量-1个,n=0时,表示其对应的括号内的-CH2为数量0个,n=1时,表示括号内的-CH2为数量1个,其他依次类推。
具体的,m=0时,表示括号内的-CH2为数量0个,m=1时,表示其对应的括号内的-CH2为数量1个,其他依次类推。
当n=-1,m=0时,结构如下:
即当n=-1,m=0时,中环化合物中间的环为七元环。当n=0,m=0或者n=-1,m=1时中间环为八元环,n=1,m=1时,中间环为十元环,当n和m等于其他整数时,依次类推。具体的,n可取-1,0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20中的任意一个数。
在一个实施方式中,n为0~5之间的整数,即n可取0、1、2、3、4和5中的任意一个数。
具体的,-X-为-CH2-、-NH-、-O-、-PH3-、-S-、-SO2-、-NTs-、-OCH2CH2CH=CH-或-CHCH3-。具体的,-R’为H或C1~C5的烷基,C1~C5的烷基可以为直链烷基或支链烷基。本实施方式中,-R’为H。更具体的,R1为H,R2为H或卤素,-R’为H,R1所取代的环为苯环,R2所取代的环为苯环,-X-为-CH2-,m为0,n为0~5之间的整数。
R1、R2、R3和R4可以相同,也可以不同。C1~C20的烷基为直链烷基或支链烷基。C1~C20的烷氧基为直链烷氧基或支链烷氧基。C6~C20的芳基可以由苯环组成也可以在苯环上取代有取代基。
在一个实施方式中,R1或R2为烷基或烷氧基时,碳链数为C1~C10。进一步的,R1或R2为烷基或烷氧基时,碳链数为C1~C5。进一步的,R1或R2为烷基或烷氧基时,碳链数为C1~C3。具体的,R1或R2可分别在两侧的环上的任意位置上取代。
上述中环化合物,包括三个并联环的基本结构,并在基本结构上取代有R1、R2、X、-A等功能性基团。该中环化合物可以由手性底物得到手性转移的产物。经细胞实验表明,该中环化合物可以有效抑制肿瘤的生长,可用作抗肿瘤的药物。
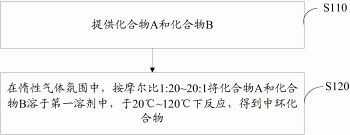
如图1所示,一种中环化合物的制备方法,包括如下步骤:
S110、提供化合物A和化合物B,其中,化合物A的结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,-R’为H或C1~C5的烷基,-X-为含C、O、N、S或P的基团,R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,n为-1~20之间的整数,m为0、1、2或3。具体的,n可取-1、0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20中的任意一个数。化合物B为能够与A发生闭环反应并提供功能性基团-A的化合物。
R1和R2可以相同,也可以不同。C1~C20的烷基为直链烷基或支链烷基。C1~C20的烷氧基为直链烷氧基或支链烷氧基。C6~C20的芳基可以由苯环组成也可以在苯环上取代有取代基。
在一个实施方式中,R1或R2为烷基或烷氧基时,碳链数为C1~C10。进一步的,R1或R2为烷基或烷氧基时,碳链数为C1~C5,例如CH3、C2H5、C5H11等。进一步的,R1或R2为烷基或烷氧基时,碳链数为C1~C3。具体的,R1或R2可分别在两侧的环上的任意位置上取代。
S120、在惰性气体氛围中,按摩尔比1:20~20:1将化合物A和化合物B溶于第一溶剂中,于20℃~120℃下反应,得到中环化合物,中环化合物的结构式为:
其中,R1为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,-R’为H或C1~C5的烷基,-X-为含C、O、N、S或P的基团,-A为-CF3、-N3、-PO(R3)2、 或-C4F9,其中,R3为C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R4为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,R1所取代的环为苯环或环己烷,R2所取代的环为苯环或环己烷,n为-1~20之间的整数,m为0、1、2或3
具体的,惰性气体可以包括氩气、氦气、氖气、氮气和氪气中的至少一种。
具体的,化合物A和化合物B的摩尔比1:20~20:1,进一步的,化合物A和化合物B的摩尔比1:5~5:1。更进一步的,化合物A和化合物B的摩尔比1:2~1:1。
具体的,第一溶剂为有机溶剂。例如可以为乙酸乙酯(EtOAc)、二氯乙烷(DCE)、酰胺(DCM)、甲基乙基醚(EtOMe)、乙腈(CH3CN)、四氢呋喃(THF)和二甲基甲酰胺(DMF)中的至少一种。
具体的,化合物B选自B1、B2、B3、B4、B5和B6中的一种。
在一个实施方式中,化合物B选自B1,B1的结构式为:
其中,-A’为-CF3或-N3。
在另一个实施方式中,化合物B选自B2,B2的结构式为:
其中,-A”为-CF3或-N3。
在另一个实施方式中,化合物B选自B3,B3的结构式为:
其中,R3为C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基。
在另一个实施方式中,化合物B选自B4,B4的结构式为:
其中,R4为C1~C20的烷基,C6~C20的芳基或C1~C20的烷氧基。
在另一个实施方式中,化合物B选自B5,B5的结构式为:
其中,R5为卤素。
在另一个实施方式中,化合物B选自B6,B6的结构式为:
C4F9SO2R6
其中,R6为卤素。
卤素具体为氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
具体的,反应时还包括在第一溶剂中加入第一催化剂,第一催化剂选自CuCN、CuI、CuSCN、CuCl、CuBr和AgNO3中的至少一种。
具体的,当化合物B选自B1或B2时,第一催化剂选自CuCN、CuI、CuSCN、CuCl和CuBr中的至少一种。
具体的,当化合物B选自B3、B5或B6时,所述第一催化剂为AgNO3。
具体的,反应温度为50℃~100℃。更进一步的,反应温度为60℃~80℃
在本实施方式中,还包括对得到的中环化合物进行分离纯化,分离纯化的方法具体为:向反应后的溶液中加入碳酸氢钠溶液,用有机溶剂进行萃取,得到的有机相用饱和氯化钠溶液洗涤,之后用无水硫酸钠干燥,层析后得到纯净的中环化合物。萃取用的有机溶剂可以为乙酸乙酯,萃取操作可重复三次。
上述中环化合物的制备方法工艺简单,可以中从手性底物得到手性转移的产物。制备得到的中环化合物包括三个并联环的基本结构,并在基本结构上取代有R1、R2、X、A等功能性基团。经细胞实验表明,该中环化合物可以有效抑制肿瘤的生长,可用作抗肿瘤的药物。
具体的,制备得到中环化合物后还包括对得到的产物进行核磁共振检测。以验证制备得到的化合物是否为所预期的结构。
将制备得到的中环化合物进行药物筛选,分别检测其对肾上皮细胞、非小细胞肿瘤细胞、子宫颈癌细胞系以及前列腺肿瘤细胞的抑制作用。经细胞实验表明,该中环化合物可以有效抑制肿瘤的生长,可用作抗肿瘤的药物。具体的,可根据需要将中环化合物制成片剂、胶囊剂、液体制剂或粉针剂等各种剂型。
以下为具体实施例
实施例1
制备化合物A1~化合物A22
提供如下结构的化合物C和化合物D,将化合物C预化合物D按摩尔比为1~2:1混合,加入四氢呋喃(THF)溶液中,加入催化剂正丁基锂(n-BuLi),正丁基锂与化合物C的摩尔比比为1~2:1。于-78℃条件下搅拌反应1h~2h,得到目标产物化合物A。具体的反应式如下:
其中,R2为H、卤素、C1~C20的烷基、C6~C20的芳基或C1~C20的烷氧基,n为-1~20之间的整数,m为0、1、2或3。
通过上述制备化合物A的反应制备的化合物A1。其中,所用的化合物C为1-溴代-2-乙烯基苯(11mmol),化合物D为7-溴-3,4-二氢萘-1(2H)-酮(10mmol),加入四氢呋喃(THF)溶液中,加入催化剂正丁基锂(n-BuLi),正丁基锂与化合物C的摩尔比比为1.1:1。于-78℃条件下搅拌反应1h~2h,得到目标产物化合物A1。具体的反应式如下:
将反应后的溶液中加入碳酸氢钠(NaHCO3)溶液,用乙酸乙酯(EtOAc)进行萃取,得到的有机相用饱和氯化钠溶液洗涤,之后用无水硫酸钠干燥。得到纯净的化合物A1,产率为65%。
化合物A2~化合物A22的制备方法与制备化合物A1类似,不同的是根据需要制备的制备化合物A2~化合物A22的结构对所用的化合物D进行调整,例如制备化合物A2对应的化合物D为7-氟-3,4-二氢萘-1(2H)-酮: 制备化合物A3对应的化合物D为3,4-二氢萘-1(2H)-酮: 制备化合物A4对应的化合物D为6-甲氧基-3,4-二氢萘-1(2H)-酮: 等。
制备得到的化合物A1~化合物A22结构式如下:
其中,A4中的Me表示甲基,A6以及A16中的N-Ts表示氮甲苯磺酰基,A21和A22中的Ph表示为苯基。
对化合物A1进行核磁共振分析,得到核磁共振结果如下:1H NMR(400MHz,CDCl3)δ7.85(dd,J=8.0,1.2Hz,1H),7.41(dd,J=7.6,1.6Hz,1H),7.35(td,J=7.6,1.6Hz,1H),7.33-7.27(m,2H),7.09-7.00(m,2H),6.31(dd,J=17.2,10.8Hz,1H),5.40(dd,J=17.2,1.2Hz,1H),4.99(dd,J=10.8,1.2Hz,1H),2.92-2.75(m,2H),2.35-2.25(m,1H),2.11-2.01(m,2H),2.01-1.93(m,1H),1.89-1.81(m,1H)。13C NMR(100MHz,CDCl3)δ144.19,144.0,136.20,135.75,135.35,130.71,130.50,130.33,127.73,127.27,127.20,126.06,119.94,115.17,74.23,37.99,29.10,19.15。HRMS(ESI)m/z结果为C18H16Br[M-OH]+311.0429,found 311.0426。
对化合物A2进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.88(d,J=8.0Hz,1H),7.41(d,J=7.5Hz,1H),7.38-7.32(m,1H),7.32-7.27(m,1H),7.14(dd,J=8.5,5.5Hz,1H),6.90(td,J=8.5,2.5Hz,1H),6.63(dd,J=10.0,2.5Hz,1H),6.29(dd,J=17.0,11.0Hz,1H),5.40(dd,J=17.0,1.5Hz,1H),4.98(dd,J=11.0,1.5Hz,1H),2.95-2.87(m,1H),2.87-2.79(m,1H),2.30(td,J=13.5,3.0Hz,1H),2.13-2.03(m,2H),2.03-1.96(m,1H),1.91-1.82(m,1H)。13C NMR(125MHz,CDCl3)δ161.61(d,J=243.1Hz),144.51,143.80(d,J=6.0Hz),136.27,135.64,132.61(d,J=3.0Hz),130.50(d,J=7.5Hz),127.90,127.51,127.41,126.10,115.44,114.88(d,J=21.3Hz),114.31(d,J=21.1Hz),74.53,38.06,29.06,19.62。19F NMR(376MHz,CDCl3)δ-115.46(s)。HRMS(ESI)m/z结果为C18H16F[M-OH]+251.1231,found 251.1236。
对化合物A3进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.49(d,J=6.5Hz,1H),7.34-7.29(m,3H),7.28-7.08(m,5H),5.51(dd,J=17.5,3.5Hz,1H),5.18(dd,J=11.0,3.5Hz,1H),3.02-2.91(m,1H),2.89-2.72(m,2H),2.35(s,1H),2.16-2.06(m,1H),2.05-1.96(m,1H),1.72-1.62(m,1H)。13C NMR(125MHz,CDCl3)δ145.78,143.90,141.54,138.25,137.98,130.88,128.80,127.80,127.45,127.40,127.36,126.95,126.27,115.17,81.26,40.12,35.83,27.12.24.45。HRMS(ESI)m/z结果为C18H17[M-OH]+233.1325,found 233.1316。
对化合物A4进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.95(d,J=8.0Hz,1H),7.41(d,J=7.5Hz,1H),7.35(t,J=7.5Hz,1H),7.28(t,J=7.5Hz,1H),6.84(d,J=8.5Hz,1H),6.70(d,J=2.0Hz,1H),6.63(dd,J=8.5,2.5Hz,1H),6.31(dd,J=17.5,11.0Hz,1H),5.39(d,J=17.5Hz,1H),4.97(d,J=11.0Hz,1H),3.79(s,3H),2.91-2.86(m,2H),2.28(td,J=13.5,2.5Hz,1H),2.15-2.05(m,2H),2.01-1.95(m,1H),1.89-1.83(m,1H)。13C NMR(125MHz,CDCl3)δ158.63,145.51,138.57,136.52,135.72,134.56,129.27,127.70,127.24,127.14,126.18,114.98,113.24,113.04,74.22,55.13,38.51,30.15,19.63。HRMS(ESI)m/z结果为C19H19O[M-OH]+263.1430,found 263.1419。
对化合物A5进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.89(d,J=7.5Hz,1H),7.42(d,J=7.5Hz,1H),7.37-7.32(m,1H),7.31-7.27(m,1H),6.93(s,1H),6.63(s,1H),6.33(t,J=15.0Hz,1H),5.40(dd,J=17.5,1.5Hz,1H),4.97(dd,J=11.5,1.5Hz,1H),2.91-2.84(m,1H),2.65-2.55(m,1H),2.33-2.25(m,4H),2.15-2.05(m,5H),2.00-1.82(m,2H)。13C NMR(125MHz,CDCl3)δ145.69,141.76,136.76,136.03,135.84,135.71,132.51,130.12,127.65,127.17,127.07,126.36,126.00,114.87,75.03,37.98,26.32,20.90,19.79,19.35。HRMS(ESI)m/z结果为C20H21[M-OH]+261.1643,found 261.1671。
对化合物A6进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.84(d,J=8.5Hz,1H),7.74(d,J=8.0Hz,2H),7.56(d,J=6.0Hz,1H),7.35(d,J=7.5Hz,1H),7.28–7.24(m,3H),7.24-7.19(m,2H),6.94(t,J=7.5Hz,1H),6.88(d,J=7.5Hz,1H),6.19(dd,J=16.5,11.0Hz,1H),5.29(d,J=17.0Hz,1H),4.82(d,J=10.5Hz,1H),4.36-4.20(m,1H),3.85(t,J=13.0Hz,1H),2.40(s,3H),2.38-2.32(m,1H),2.11(s,1H),1.98-1.92(m,1H)。13C NMR(125MHz,CDCl3)δ143.86,142.83,137.34,136.39,135.89,135.80,134.09,129.81,128.54,128.50,127.86,127.71,127.27,127.11,126.60,124.69,121.90,115.59,73.09,43.29,36.36,21.51。HRMS(ESI)m/z结果为C24H24NO3S[M+H]+406.1477,found 406.1471。
对化合物A7进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.96(d,J=7.5Hz,1H),7.44(d,J=7.5Hz,1H),7.37(t,J=7.5Hz,1H),7.31(t,J=7.5Hz,1H),7.22(d,J=8.0Hz,1H),7.18-7.10(m,1H),6.92(d,J=4.0Hz,2H),6.30(dd,J=17.0,11.0Hz,1H),5.41(d,J=17.0Hz,1H),5.00(d,J=11.0Hz,1H),3.48(td,J=13.0,2.5Hz,1H),2.78-2.73(m,1H),2.64-2.49(m,1H),2.29-2.11(m,2H)。13C NMR(125MHz,CDCl3)δ144.25,138.51,135.82,135.42,133.36,129.16,127.96,127.63,127.60,127.47,127.10,125.98,125.06,115.57,73.16,37.03,23.19。HRMS(ESI)m/z结果为C17H15S[M-OH]+251.0889,found 251.0879。
对化合物A8进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.50(d,J=7.5Hz,1H),7.35-7.30(m,3H),7.27-7.22(m,2H),7.22-7.10(m,3H),5.54(d,J=17.0Hz,1H),5.20(d,J=11.0Hz,1H),3.01-2.94(m,1H),2.88-2.75(m,2H),2.41(d,J=5.5Hz,1H),2.14-2.07(m,1H),2.07-1.97(m,1H),1.82-1.75(m,2H),1.72-1.63(m,1H)。13C NMR(125MHz,CDCl3)δ145.77,143.85,141.50,138.24,137.97,130.85,128.77,127.77,127.46,127.37,127.34,126.95,126.24,115.12,81.24,40.11,35.83,27.11,24.46。HRMS(ESI)m/z结果为C19H21O[M+H]+265.1592,found 265.1587。
对化合物A9进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.45(d,J=8.0Hz,1H),7.28(t,J=7.5Hz,1H),7.23-7.03(m,5H),6.90-85(m,1H),5.50(dd,J=17.0,1.5Hz,1H),5.19(dd,J=11.0,1.5Hz,1H),2.92-2.61(m,3H),2.45-2.24(m,1H),2.09-2.02(m,1H),1.95-1.88(m,1H),1.84-1.67(m,1H),1.67-1.48(m,2H)。13C NMR(125MHz,CDCl3)δ161.53(d,J=241.9Hz),148.52(d,J=5.9Hz),142.30,138.40,138.19,137.01(d,J=3.1Hz),132.16(d,J=7.5Hz),129.24,127.90,127.46,127.33,115.59,114.60(d,J=23.1Hz),113.64(d,J=20.4Hz),81.11,40.39,35.27,27.27,24.83。19F NMR(376MHz,CDCl3)δ-116.66。HRMS(ESI)m/z结果为C19H20FO[M+H]+283.1498,found 283.1493。
对化合物A10进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.90(d,J=7.5Hz,1H),7.38-7.29(m,4H),7.16-7.13(m,1H),7.10(d,J=8.0Hz,1H),5.98(d,J=15.5Hz,1H),5.89-5.81(m,1H),2.97-2.90(m,1H),2.87-2.78(m,1H),2.43-2.32(m,2H),2.09-1.96(m,2H),1.92-1.86(m,1H),1.68(dd,J=6.5,2.0Hz,3H)。13C NMR(125MHz,CDCl3)δ144.23,143.85,135.92,135.62,130.80,130.61,130.42,130.41,128.09,127.29,127.02,126.49,125.84,120.06,74.32,37.99,29.38,19.38,18.59。HRMS(ESI)m/z结果为C19H18Br[M-OH]+325.0592,found 325.0582。
对化合物A11进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.52(d,J=7.6Hz,1H),7.28-7.21(m,2H),7.20-7.15(m,2H),6.99(td,J=9.0,2.4Hz,1H),6.96-6.88(m,1H),6.78(dd,J=8.5,2.5Hz,1H),5.52(dd,J=17.5,1.5Hz,1H),5.13(dd,J=11.0,1.5Hz,1H),3.10-2.99(m,1H),2.89-2.67(m,2H),2.43-2.36(m,1H),2.35(s,1H)。13C NMR(125MHz,CDCl3)δ16.36(d,J=243Hz),149.81(d,J=6.9Hz),141.48,138.91(d,J=2.4Hz),136.64,136.54,127.82,127.80,127.16,126.46,126.10(d,J=8.4Hz),115.59(d,J=22.5Hz),115.24,110.96(d,J=22.0Hz),85.89(d,J=1.9Hz),43.37,29.08。19F NMR(376MHz,CDCl3)δ-115.57(s)。HRMS(ESI)m/z结果为C17H14F[M-OH]+237.1080,found 237.1066。
对化合物A12进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.91(d,J=7.5Hz,1H),7.28-7.24(m,2H),7.19-7.14(m,3H),7.09-7.04(m,1H),6.89(d,J=7.5Hz,1H),5.61-5.52(m,1H),4.89(d,J=10.0Hz,1H),4.79(d,J=17.0Hz,1H),3.03(dd,J=15.5,7.0Hz,1H),2.95-2.82(m,3H),2.20-2.05(m,3H),2.02(s,1H),1.91-1.85(m,1H)。13C NMR(100MHz,CDCl3)δ145.88,142.66,137.54,136.69,136.22,131.03,129.08,127.86,127.42,126.94,126.83,126.52,125.64,115.57,74.53,38.62,37.12,29.80,19.66。HRMS(ESI)m/z结果为C19H21O[M+H]+265.1592,found 265.1587。
对化合物A13进行核磁共振分析,得到核磁共振结果如下:1H NMR(400MHz,CDCl3)δ7.89(dd,J=5.6,3.6Hz,1H),7.33-7.27(m,2H),7.24-7.14(m,2H),6.92(td,J=8.4,2.8Hz,1H),6.63(dd,J=9.6,2.8Hz,1H),5.72-5.61(m,1H),4.96(dq,J=10.0,1.6Hz,1H),4.83(dq,J=16.8,1.6Hz,1H),3.09(dd,J=16.0,6.8Hz,1H),2.99-2.84(m,3H),2.23-2.04(m,4H),1.96-1.88(m,1H)。13C NMR(100MHz,CDCl3)δ161.53(d,J=243.1Hz),145.13,144.45(d,J=5.9Hz),137.39,136.13,132.28(d,J=3.0Hz),131.29,130.63(d,J=7.5Hz),127.25,126.48,125.82,115.72,114.73(d,J=21.2Hz),114.17(d,J=21.1Hz),74.54,38.34,37.11,29.08,19.66。19F NMR(376MHz,CDCl3)δ-115.49。HRMS(ESI)m/z结果为C19H20FO[M+H]+283.1498,found 283.1493。
对化合物A14进行核磁共振分析,得到核磁共振结果如下:1H NMR(400MHz,CDCl3)δ7.85(dd,J=5.6,3.6Hz,1H),7.32-7.26(m,3H),7.21(dd,J=5.6,3.6Hz,1H),7.08-7.02(m,2H),5.69–5.57(m,1H),4.95(dq,J=10.0,1.6Hz,1H),4.80(dq,J=16.8,1.6Hz,1H),3.08(dd,J=15.6,6.4Hz,1H),2.95-2.77(m,3H),2.21(s,1H),2.19-2.01(m,3H),1.92-1.84(m,1H)。13C NMR(100MHz,CDCl3)δ144.93,144.76,137.22,135.99,135.59,131.36,130.84,130.70,130.51,127.24,126.51,125.82,120.15,115.67,74.43,38.48,37.10,29.29,19.39。HRMS(ESI)m/z结果为C19H20BrO[M+H]+343.0698,found 343.0692。
对化合物A15进行核磁共振分析,得到核磁共振结果如下:1H NMR(400MHz,CDCl3)δ7.94-7.88(m,1H),7.31–7.27(m,2H),7.23-7.19(m,1H),7.00(dd,J=8.4,2.0Hz,1H),6.83(d,J=8.4Hz,1H),6.66(d,J=1.6Hz,1H),5.68-5.57(m,1H),4.93(dd,J=10.4,1.6Hz,1H),4.81(dd,J=17.2,1.6Hz,1H),4.25(dt,J=11.4,2.0Hz,1H),4.29–4.23(m,1H),3.09(dd,J=15.6,6.4Hz,1H),2.94(dd,J=15.6,6.4Hz,1H),2.52-2.42(m,1H),2.38(s,1H),2.14(s,3H),2.01(dt,J=14.4,2.8Hz,1H)。13C NMR(101MHz,CDCl3)δ152.13,143.97,137.41,136.45,131.40,130.43,130.18,128.71,127.95,127.33,126.96,125.74,117.09,115.64,70.93,63.27,37.37,36.99,20.42。HRMS(ESI)m/z结果为C19H19O[M-OH]+263.1430,found 263.1426。
对化合物A16进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.93(d,J=8.0Hz,1H),7.71(d,J=8.0Hz,2H),7.53(d,J=7.5Hz,1H),7.25-7.19(m,4H),7.16-7.09(m,2H),6.98(t,J=8.0Hz,1H),6.87(d,J=8.0Hz,1H),5.50-5.40(m,1H),4.87(d,J=10.0Hz,1H),4.69(d,J=17.0Hz,1H),4.45-4.38(m,1H),3.93-3.95(m,1H),2.81-2.72(m,1H),2.64(dd,J=15.0,5.0Hz,1H),2.39(s,3H),2.19-2.11(m,1H),2.04(s,1H),1.97-1.92(m,1H)。13C NMR(125MHz,CDCl3)δ143.79,143.60,137.44,137.29,136.40,136.24,134.92,131.35,129.92,128.58,128.28,127.45,127.09,126.99,125.79,124.99,122.70,115.77,73.22,43.40,37.09,36.38,21.54。HRMS(ESI)m/z结果为C25H26NO3S[M+H]+420.1633,found 420.1628。
对化合物A17进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.94(d,J=6.5Hz,1H),7.32-7.26(m,4H),7.24-7.19(m,1H),7.11(t,J=7.5Hz,1H),6.94(d,J=7.5Hz,1H),5.65-5.55(m,1H),4.93(d,J=10.0Hz,1H),4.83(d,J=17.0Hz,1H),3.10-2.95(m,2H),2.87(dd,J=16.0,6.5Hz,1H),2.32-2.24(m,1H),2.13-2.08(m,2H),1.97-1.91(m,2H),1.49(d,J=6.5Hz,3H)。13C NMR(125MHz,CDCl3)δ146.14,142.55,141.40,137.59,136.31,131.08,127.93,127.70,126.97,126.74,126.69,126.48,125.66,115.60,75.09,38.02,37.11,32.98,29.00,20.94。HRMS(ESI)m/z结果为C20H23O[M+H]+279.1479,found 279.1473。
对化合物A18进行核磁共振分析,得到核磁共振结果如下:1H NMR(400MHz,CDCl3)δ7.28-7.21(m,3H),7.16-7.11(m,1H),7.07(dd,J=8.4,6.0Hz,1H),6.91(dd,J=11.2,2.4Hz,1H),6.83(td,J=8.0,2.8Hz,1H),5.93-5.82(m,1H),5.03(dq,J=10.0,1.6Hz,1H),4.95(dq,J=16.8,1.6Hz,1H),3.49-3.37(m,2H),2.98-2.88(m,1H),2.78-2.69(m,1H),2.65-2.55(m,1H),2.33(s,1H),2.15-2.08(m,1H),2.02-1.94(m,1H),1.74-1.66(m,3H)。13C NMR(100MHz,CDCl3)δ161.36(d,J=241.7Hz),148.5(d,J=6.0Hz),144.20,138.18,137.06(d,J=3.1Hz),132.12(d,J=7.5Hz),132.04,128.31,127.44,127.28,126.00,115.78,115.10(d,J=22.9Hz),113.65(d,J=20.5Hz),81.01,39.90,38.28,34.91,27.16,24.56。HRMS(ESI)m/z结果为C20H22FO[M+H]+297.1655,found 297.1649。
对化合物A19进行核磁共振分析,得到核磁共振结果如下:1H NMR(400MHz,CDCl3)δ7.28-7.21(m,3H),7.13-7.08(m,2H),6.99(td,J=8.8,2.4Hz,1H),6.81(dd,J=8.8,2.4Hz,1H),6.00-5.87(m,1H),5.03(dd,J=10.0,1.6Hz,1H),4.94(dq,J=17.2,1.6Hz,1H),3.49(dd,J=16.0,6.4Hz,1H),3.35(dd,J=16.0,6.4Hz,1H),3.12-3.00(m,1H),2.85-2.76(m,1H),2.70-2.61(m,1H),2.51-2.43(m,1H),2.28(s,1H)。13C NMR(100MHz,CDCl3)δ162.39(d,J=242.9Hz),150.38(d,J=6.9Hz),142.42,138.78(d,J=2.4Hz),138.42,137.68,131.77,127.60,126.89,126.15(d,J=8.4Hz),125.62,115.67,115.55(d,J=23.7Hz),110.89(d,J=22.1Hz),86.19,43.68,37.83,29.06。HRMS(ESI)m/z结果为C18H18FO[M+H]+269.1336,found 269.1339。
对化合物A20进行核磁共振分析,得到核磁共振结果如下:1H NMR(400MHz,CDCl3)δ7.91-7.86(m,1H),7.28-7.20(m,2H),7.19-7.11(m,3H),7.06-7.01(m,1H),6.87(d,J=7.6Hz,1H),4.77(d,J=0.8Hz,1H),4.48(d,J=0.8Hz,1H),3.02(d,J=16.0Hz,1H),2.96-2.77(m,3H),2.24-1.99(m,4H),1.90-1.82(m,1H),1.39(s,3H)。13C NMR(100MHz,CDCl3)δ146.35,145.37,142.59,136.76,135.57,130.82,129.02,127.93,127.39,126.87,126.68,125.70,112.76,74.72,41.02,38.32,29.90,22.42,19.67。HRMS(ESI)m/z结果为C20H21[M-OH]+261.1643,found 261.1635。
对化合物A21进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.78–7.76(m,1H),7.60–7.58(m,1H),7.56(d,J=7.6Hz,2H),7.53–7.48(m,1H),7.44(t,J=7.5Hz,2H),7.40–7.34(m,3H),6.26(s,1H),5.62(dd,J=17.3,1.4Hz,1H),5.29(dd,J=10.9,1.4Hz,1H),2.70(dt,J=17.4,4.6Hz,1H),2.57–2.48(m,1H),2.33(s,1H),2.28–2.18(m,1H),2.11–2.02(m,2H),1.90–1.84(m,1H)。13C NMR(126MHz,CDCl3)δ144.24,141.30,139.44,137.17,136.42,129.84,128.54,128.01,127.77,127.53,127.52,126.61,125.65,115.14,73.37,36.92,27.43,19.82。HRMS(ESI)m/z结果为C20H19[M-OH]+259.1487,found 259.1481。
对化合物A22进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.70(dd,J=7.5,1.5Hz,1H),7.54(dd,J=7.0,2.0Hz,1H),7.34-7.27(m,5H),7.20(d,J=7.5Hz,1H),7.15-7.11(m,2H),6.14(s,1H),5.57(dd,J=17.5,1.5Hz,1H),5.22(dd,J=11.0,1.5Hz,1H),2.76-2.58(m,2H),2.46-2.39(m,1H),2.00-1.88(m,3H),1.83-1.77(m,1H),1.73-1.69(m,1H),1.53-1.48(m,1H)。13C NMR(125MHz,CDCl3)δ144.59,142.61,138.13,137.52,137.00,128.71,127.85,127.73,127.56,127.37,126.25,125.34,114.36,77.90,39.85,26.63,26.37,22.19。HRMS(ESI)m/z结果为C17H14F[M-OH]+273.1638,found 273.1634。
以上核磁共振分析的结果表明,化合物A1~化合物A22的结构如预期所示。可进一步用于制备中环化合物。
实施例2
制备化合物A23~化合物A26
提供如下结构式的化合物C和化合物D,将化合物C预化合物D按摩尔比为1~2:1混合,加入Et2O/己烷溶液(Et2O与己烷的比例为1~2:2~1)中,加入催化剂正丁基锂(n-BuLi),正丁基锂与化合物C的摩尔比比为1.1:1。于-78℃条件下搅拌反应1h~2h,得到目标产物化合物A。具体的反应式如下:
通过上述制备化合物A23时,所用的化合物C为1-烯丙基-1-(碘甲基)环己烷(2.3mmol),化合物D为3,4-二氢萘-1(2H)-酮(2.3mmol)。
化合物A24~化合物A26的制备方法与制备化合物A1类似,不同的是根据需要制备的制备化合物A24~化合物A26的结构对所用的化合物D进行调整,例如制备化合物A24对应的化合物D为 制备化合物A25对应的化合物D为 制备化合物A26对应的化合物D为
制备得到的化合物A24~化合物A26结构式如下:
对化合物A23进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.64(d,J=7.5Hz,1H),7.23(t,J=7.5Hz,1H),7.17(t,J=7.5Hz,1H),7.07(d,J=7.5Hz,1H),6.05-5.95(m,1H),5.14-5.07(m,2H),2.81(t,J=6.0Hz,2H),2.44(dd,J=14.5,7.5Hz,1H),2.37-2.30(m,2H),1.97-1.87(m,4H),1.81(s,1H),1.63-1.54(m,2H),1.54-1.44(m,6H),1.42-1.38(m,2H),1.37-1.29(m,1H)。13C NMR(125MHz,CDCl3)δ145.26,136.18,135.85,128.66,126.71,126.41,126.09,116.79,74.56,48.34,41.35,37.69,37.44,36.83,36.79,29.50,26.14,21.84,21.64,19.86。HRMS(unstable to be detected)。
对化合物A24进行核磁共振分析,得到核磁共振结果如下:1H NMR(500MHz,CDCl3)δ7.64(brs,1H),7.54(brs,1H),7.37–7.30(m,2H),7.28–7.22(m,1H),7.10(dd,J=8.0,1.0Hz,1H),6.99(dd,J=17.3,10.9Hz,1H),6.92(t,J=7.5Hz,1H),5.36(dd,J=17.3,1.6Hz,1H),4.93(d,J=11.0Hz,1H),4.28(dd,J=9.6,5.4Hz,2H),2.52(brs,2H),2.14–2.05(m,1H),2.05–1.92(m,1H),1.74(d,J=10.8Hz,1H),1.49–1.41(m,1H)。13C NMR(126MHz,CDCl3)δ154.73,141.20,138.18,128.86,128.74,128.29,127.53,126.90,125.91,124.49,122.52,112.96,78.19,76.85,42.91,25.55,22.09。HRMS(ESI)m/z结果为C19H19O[M-OH]+263.1430,found 263.1426。
对化合物A25进行核磁共振分析,得到核磁共振结果如下:1H NMR(400MHz,CDCl3)δ7.71-7.66(m,1H),7.61(dd,J=5.6,3.6Hz,1H),7.35(dd,J=5.6,3.6Hz,2H),7.27-7.21(m,1H),7.12(dd,J=17.6,10.8Hz,1H),6.98(d,J=8.4Hz,1H),6.84-6.74(m,2H),5.44(dd,J=17.6,1.6Hz,1H),5.19(s,1H),5.03-4.96(m,1H),4.40-4.27(m,2H),2.58-2.42(m,2H),2.00-1.86(m,2H),1.86-1.75(m,2H),1.75-1.60(m,3H),1.58-1.46(m,2H),1.46-1.29(m,1H)。13C NMR(100MHz,CDCl3)δ13C NMR(101MHz,CDCl3)δ
中环化合物及其制备方法和应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0