IPC分类号 : C07H19/06,C07H1/00,C07D339/04,C07D339/08,C07D339/00,C07D345/00,A61P35/00
专利摘要
一种抗癌前药分子及其制备方法与靶向化合物,涉及有机合成及分子医药领域。本发明提供一种抗癌前药分子的靶向化合物,该靶向化合物能够被癌细胞内过量表达的蛋白选择性识别;一种抗癌前药分子的制备方法,将前述的靶向化合物连接到抗癌活性分子的氨基或者羟基上,通过本方法将靶向化合物与抗癌活性分子连接,制得抗癌前药分子;在靶向化合物被肿瘤细胞内高表达的蛋白特异性识别后,释放出抗癌前药分子,直接作用于癌症细胞,达到靶向治疗的目的。
权利要求
1.一种抗癌前药分子的制备方法,其特征在于,包括:
将靶向化合物连接到抗癌活性分子的氨基或者羟基,得到所述抗癌前药分子;所述靶向化合物结构式为:
式中,X为S或者Se,R
所述抗癌活性分子的结构式为:
2.根据权利要求1所述的制备方法,其特征在于,R
3.根据权利要求2所述的制备方法,其特征在于,所述活性基团为羟基,所述制备方法包括:
将所述靶向化合物的-OH基团与三光气/光气反应,转化为-OCOCl,再将-OCOCl与所述抗癌活性分子中的-NH
4.根据权利要求2所述的制备方法,其特征在于,包括:所述活性基团为羧基,所述制备方法包括:
将所述靶向化合物的-COOH基团与所述抗癌活性分子中的-NH
5.根据权利要求2所述的制备方法,其特征在于,包括:所述活性基团为氨基,所述制备方法包括:
所述靶向化合物的-NH
6.一种抗癌前药分子,其特征在于,所述抗癌前药分子由权利要求1-5任一项所述的制备方法制得。
7.根据权利要求6所述的抗癌前药分子,其特征在于,其结构式为:
说明书
技术领域
本发明涉及有机合成及分子医药领域,具体而言,涉及一种抗癌前药分子及其制备方法与靶向化合物。
背景技术
化疗即通过使用化学治疗药物杀灭癌细胞达到治疗目的。化疗是目前治疗癌症最有效的手段之一,和手术、放疗一起并称癌症的三大治疗手段。
目前,化疗已经成为了临床中主要治疗癌症的手段,然而许多药物小分子由于其较高的毒性和较低的选择性,导致对正常细胞和组织损伤较大,从而带来一系列的副作用,最终限制了一系列药物分子的临床运用。另一方面,目前许多流行的抗癌药物,由于其生物半衰期短而需要频繁给药,不仅带来经济的损失,更严重的是加大了药物对正常机体的持续损伤。
发明内容
本发明的第一目的在于提供一种抗癌前药分子的靶向化合物,该靶向化合物结构简单,简单易得,合成方便,具有较好的靶向效果,具备较高的应用价值。
本发明的第二目的在于提供一种抗癌前药分子的制备方法,本方法通过简单的反应将抗癌活性分子与靶向化合物连接,反应产率高,纯度好。
本发明的第三目的在于提供一种抗癌前药分子。
本发明的实施例是这样实现的:
一种抗癌前药分子的靶向化合物,其结构式为:
式中,X为S或者Se,R1、R2、R3中至少一个为活性基团,活性基团包括羧基、羟基和氨基中的任一种。
一种抗癌前药分子的制备方法,包括:
将上述的靶向化合物连接到抗癌活性分子的氨基或者羟基,得到抗癌前药分子。
一种抗癌前药分子,抗癌前药分子由上述的制备方法制得。
本发明实施例的有益效果是:
本发明实施提供了一种抗癌前药分子的靶向化合物,该靶向化合物能够被癌细胞内过量表达的蛋白选择性识别;一种抗癌前药分子的制备方法,将前述的靶向化合物连接到抗癌活性分子的氨基或者羟基上,通过本方法将靶向化合物与抗癌活性分子连接,制得抗癌前药分子;在靶向化合物被肿瘤细胞内高表达的蛋白特异性识别后,释放出抗癌药物分子,直接作用于癌症细胞,达到靶向治疗的目的。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实验例1所提供的二硫/二硒五元环化合物与硫氧还蛋白还原酶(TrxR)的作用结果图;
图2为本发明实验例1所提供的二硫/二硒五元环化合物与谷胱甘肽(GSH)的作用结果图;
图3为本发明实验例1所提供的二硫/二硒六元环化合物与TrxR的作用结果图;
图4为本发明实验例1所提供的二硫/二硒六元环化合物与GSH的作用结果图;
图5为本发明实验例1所提供的与萘相连的环状二硫/二硒化合物与TrxR的作用结果图;
图6为本发明实验例1所提供的与萘相连的环状二硫/二硒化合物与GSH的作用结果图;
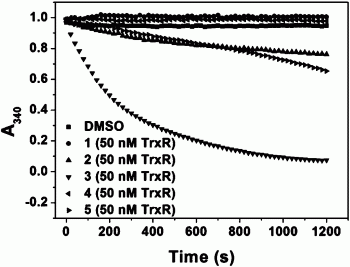
图7为本发明实验例2所提供的二硫/二硒五元环化合物1与不同浓度TrxR的作用结果图;
图8为本发明实验例2所提供的二硫/二硒五元环化合物2与不同浓度TrxR的作用结果图;
图9为本发明实验例2所提供的二硫/二硒五元环化合物3与不同浓度TrxR的作用结果图;
图10为本发明实验例3所提供的前药分子S-Gem与TrxR作用结果图;
图11为本发明实验例4所提供的抗癌药物吉西他滨(Gem)的标准曲线图;
图12为本发明实验例4所提供的抗癌药物Gem的释放图;
图13为本发明实验例5所提供的抗癌前药分子对SMMC-7721细胞的毒性结果图;
图14为本发明实验例5所提供的抗癌前药分子对A549细胞的毒性结果图;
图15为本发明实验例5所提供的抗癌前药分子对Hela细胞的毒性结果图;
图16为本发明实验例5所提供的抗癌前药分子对不同细胞的毒性结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的一种抗癌前药分子及其制备方法与靶向化合物进行具体说明。
硫氧还蛋白还原酶(TrxR)是一种含硒蛋白,它与NADPH及它的底物硫氧还蛋白(Trx)一起构成了硫氧还蛋白系统,这个系统是一个高度保守的,几乎存在于所有生命中。硫氧还蛋白系统在细胞增殖、分化和死亡、DNA修复、血管生成和胚胎形成等生理过程中涉及的氧化还原信号调节通路中占据着非常重要的作用。近几年,由于TrxR在生物医学中的重要作用,受到了广泛的关注。尤其重要的是,大量研究表明,与正常组织相比,TrxR在多种肿瘤类型中都处于过表达的状态,如非小细胞肺癌、乳腺癌、肝癌、宫颈癌等。可以特异性检测活细胞中TrxR活性的探针;该探针由1,2-二硫戊环结构和一个猝灭的萘二甲酰亚胺荧光团组成,生物体内的TrxR能够特异性特还原探针中的二硫键,随后发生分子内环化从而释放出荧光团,达到特异性检测TrxR活性的目的。研究发现五元环的二硫/二硒化合物能够特异性地被TrxR还原。将五元环的二硫/二硒化合物与抗癌前药分子连接,得到生物活性小的前药化合物;前药化合物可以特异性的通过癌细胞中的过表达的TrxR激活,释放出抗癌前药分子。
本发明实施例提供了一种抗癌前药分子的靶向化合物,其结构式为:
式中,X为S或者Se,R1、R2、R3中至少一个为活性基团,活性基团包括羧基、羟基和氨基中的任一种。
进一步地,R1和R3为氢;R2选自羧基、羟基和氨基。
上的抗癌前药分子的靶向化合物在制备抗癌前药分子中应用。
本发明实施例还提供一种抗癌前药分子的制备方法,包括:
将上述的靶向化合物连接到抗癌活性分子的氨基或者羟基,得到抗癌前药分子。
进一步地,活性基团为羟基,制备方法包括:
将靶向化合物的-OH基团与三光气/光气反应,转化为-OCOCl,再将-OCOCl与抗癌活性分子中的-NH2或-OH基团反应。
靶向化合物的-OH基团与三光气/光气反应,转变成-OCOCl;当抗癌活性分子中仅有-NH2基团的时候,-OCOCl与-NH2基团反应;当抗癌活性分子中仅有-OH基团的时候,-OCOCl与-OH基团反应;如果抗癌活性分子中同时具有-NH2或-OH基团的时候,抗癌活性分子可以先与-OH基团保护剂反应,保护-OH基团,然后-OCOCl与-NH2基团反应,再对-OH基团进行脱保护。
上述制备方法包括:活性基团为羧基,制备方法包括:
将靶向化合物的-COOH基团与抗癌活性分子中的-NH2或-OH基团反应。
上述的制备方法,包括:活性基团为氨基,制备方法包括:
靶向化合物的-NH2基团经反应转化成-NCO,再将-NCO与抗癌活性分子中的-NH2或-OH基团反应。
上述抗癌活性分子的结构式为:
本发明实施例还提供一种抗癌前药分子,抗癌前药分子由上述的制备方法制得。
进一步地,上抗癌前药分子,其结构式为:
中的一种。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供了一种靶向化合物,其结构式为:
式中,X为S或者Se,R1、R2、R3中至少一个为活性基团,活性基团包括羧基、羟基和氨基中的任一种。
靶向化合物可以是: 中的一种,也可以是其他结构式类型;只要符合前述的通式和限定条件即可。
进一步地,优选R1和R3为氢;R2选自羧基、羟基和氨基。则靶向化合物的通式为: 中的一种。
实施例2
本实施例提供了一种抗癌前药分子(命名为S-Gem),其结构式为:
制备该抗癌前药分子(S-Gem)的反应式为:
其制备方法如下:
S1.将抗癌前药分子吉西他滨Gem(1g,3.8mmol)溶于25mL无水DMF(二甲基甲酰胺)中,依次加入咪唑(0.78g,11.5mmol)和TBDMSCl(叔丁基二甲基氯硅烷)(1.5g,9.6mmol);室温搅拌过夜,反应完成后减压除去溶剂,再用乙酸乙酯萃取,有机相用饱和碳酸氢钠溶液洗涤,无水硫酸钠干燥,过滤,旋干,硅胶柱层析色谱分离得到TBSGem。
S2.氩气保护下,将1mmol环戊胺加入到25mL无水二氯甲烷中,然后加入吡啶(118mg,1.5mmol),于冰浴下加入三光气(109mg,1.1mmol),然后室温搅拌,点板监测,原料反应完后即得到环戊胺的氯甲酸酯溶液;将TBSGem(492mg,1mmol)溶于10mL无水THF(四氢呋喃)中,加入1.5mmol吡啶,然后于冰浴下将之前制成的环戊胺的氯甲酸酯溶液缓慢滴加至TBSGem溶液中,移至室温,搅拌2h,反应完后旋蒸除去溶剂,用乙酸乙酯水萃取,分离有机相,无水硫酸钠干燥,过滤,旋干,硅胶柱层析色谱分离得到C-TBSGem。
S3.将C-TBSGem(150mg,0.25mmol)溶于20mL重蒸的THF中,向其中加入1M四丁基氟化铵的THF溶液(1.5mL,1.5mmol)。室温搅拌2h。反应液用硅胶柱层析色谱分离得到C-Gem。
S4.氩气保护下,将1mmol靶向化合物 加入到25mL无水二氯甲烷中,然后加入吡啶(118mg,1.5mmol),于冰浴下加入三光气(109mg,1.1mmol),然后室温搅拌,点板监测,原料反应完后即得到靶向化合物 的酰氯化溶液。将TBSGem(492mg,1mmol)溶于10mL无水THF中,加入1.5mmol吡啶,然后于冰浴下将之前制成的靶向化合物 的氯甲酸酯溶液缓慢滴加至TBSGem中,移至室温,搅拌2h,反应完后旋蒸除去溶剂,用乙酸乙酯水萃取,分离有机相,无水硫酸钠干燥,过滤,旋干,硅胶柱层析色谱分离得到S-TBSGem。
S5.将S-TBSGem(160mg,0.25mmol)溶于20mL重蒸的THF中,向其中加入1M四丁基氟化铵的THF溶液(1.5mL,1.5mmol)。室温搅拌2h。反应液用硅胶柱层析色谱分离得到抗癌前药分子S-Gem。
硒元素和硫元素均是氧族元素,具有相似的性质,因此,可以用硒原子(Se)替换硫原子(S)。
同理,当靶向化合物的活性基团为-COOH羧基时,通过羟基保护反应保护抗癌活性分子的羟基,然后-COOH活性基团与抗癌活性分子的氨基发生反应形成酰胺键。
当靶向化合物的活性基团为-COOH羧基时,-COOH羧基可以自己与抗癌活性分子的-OH基团发生酯化反应。
当靶向化合物的活性基团为-NH2的时候,可以将抗癌活性分子的-OH基团与三光气反应转变成-OCOCl基团,然后活性基团-NH2与-OCOCl基团反应,得到产物。
需要说明的是,本实施例中优选了抗癌药物吉西他滨Gem作为抗癌活性分子,抗癌活性分子还可以是其他的含有氨基和/或羟基等活性基团的抗癌药物。
实施例3
本实施例提供了一种抗癌前药分子,其结构式为:
制备该抗癌前药分子的反应式如下:
实施例4
本实施例提供了一种抗癌前药分子,其结构式为:
制备该抗癌前药分子的反应式如下:
实验例1
本实验例提供对实施例1提供的部分二硫/二硒五元环化合物与TrxR或GSH的相互作用的机理。
本实验例通过实验合成一系列二硫/二硒五元环化合物、二硫/二硒六元环化合物和萘相连的二硫/二硒环状化物分别作为实验对象;系列化合物(化学式下方有对应的数字代号)如下:
二硫/二硒五元环化合物与TrxR的反应:在37℃下,将终浓度为100μM的环状化合物(数字代号1-13)、TrxR(50nM)和NADPH(150μM)混合于500μL的TE(50mM Tris-HCl,1mMEDTA,pH=7.4)缓冲溶液中,通过紫外分光光度计检测20min内A340处的动力学衰减。所有的反应体系中。DMSO含量为1%。
二硫/二硒五元环化合物与GSH的反应:在37℃下,将终浓度为100μM的环状化合物(数字代号1-13)、TrxR(50nM)和NADPH(150μM)混合于500μL的TE(50mM,pH=7.4)缓冲溶液中,通过紫外分光光度计检测20min内A340处的动力学衰减。所有的反应体系中DMSO含量为1%。
如图1和图2所示,五元环二硫化合物2和3与TrxR(50nM)的反应速率明显要大于与GSH(1mM)的反应速率,体现了化合物2和3其对TrxR具有非常好的选择性。
如图3和图4所示,六元环的二硫/二硒化合物与TrxR(50nM)和GSH(1mM)的反应速率都较小,说明TrxR和GSH还原六元环二硫二硒化合物的能力较小,也体现不了对TrxR的选择性。
如图5和图6所示,与萘相连的环状二硫二硒化合物与TrxR(50nM)和GSH(1mM)的反应速率都较小,体现不了这类化合物对TrxR的选择性。
综上所述,五元环的二硫/二硒化合物尤其是五元环二硫化合物2和3对TrxR具有非常好的选择性。
实验例2
本实验例验证不同浓度的TrxR与五元环的二硫/二硒化合物的相互作用。
实验方法参考实验例1的方法,其中U498C-TrxR1就是将TrxR1还原活性位点498位的硒半胱氨酸突变成半胱氨酸。本实验例选取实验例1中数字代码为1、2和3的三个五元环二硫化合物作为实验对象。
如图7、图8和图9所示,随着TrxR1浓度的增加,三个化合物与TrxR的反应速率也随之增加,其中化合物2和3的反应速率增加得尤其明显,而当用350nM的U498C-TrxR1代替TrxR1后,反应速率大大降低,说明了TrxR活性位点硒半胱氨酸对于TrxR还原化合物2和3是非常重要的。
实验例3
本实验例提供对实施例2合成的抗癌前药分子(命名为S-Gem)与TrxR的相互作用。
实验中制备了一种非二硫/二硒五元环化合物(命名为C-Gem)作为对照。制备C-Gem的反应式为:
设置6组实验,第一组C-Gem中加入50nM的TrxR和150μM的NADPH;第二组S-Gem中加入150μM的NADPH;第三组S-Gem中加入50nM的TrxR和150μM的NADPH;第四组S-Gem中加入100nM的TrxR和150μM的NADPH;第五组S-Gem中加入350nM的U498C-TrxR和150μM的NADPH;第六组S-Gem中加入1mM的GSH、0.5U/mL的谷胱甘肽还原酶GR(glutathione reductase,GR)和150μM的NADPH。通过检测反应中NADPH在A340的吸光度值的变化来表征S-Gem与TrxR的反应速率。总体积为500μL。
如图10所示,C-Gem不能与TrxR作用。当只加NADPH时,S-Gem不能与NADPH作用,排除了NADPH的干扰。而S-Gem与TrxR的反应速率随着TrxR浓度的增加而增加。当用U498C-TrxR代替TrxR后,反应速率明显降低。当用0.5U/mL的GR和1mM的GSH代替TrxR后,DANPH的衰减速率大大降低。C-Gem由于没有可被还原的二硫键,所以其不与TrxR反应。S-Gem能够与TrxR反应,且反应速率与TrxR的浓度呈正相关。与100nM的TrxR相比,350nM的U498C-TrxR与S-Gem的反应速率大大下降,可知TrxR与S-Gem的反应活性与其498位的Sec息息相关。与50nM的TrxR相比,1mM的GSH与S-Gem的反应速率非常小,体现了S-Gem对TrxR的选择性。
实验例4
与TrxR相互作用后,释放出抗癌活性分子Gem的情况。
采用HPLC检测方法;将终浓度为100μM的S-Gem、25nM的TrxR和200μM的NADPH混合于200mL TE缓冲充液中,DMSO含量为2%。然后置于37℃下分别孵育15min、30min、1h、2h和4h。孵育完后加入500μL的甲醇,置于-80℃冰箱冷冻1h使TrxR蛋白变性析出,离心除去蛋白,然后通过HPLC分析溶液中Gem的含量。流动相为甲醇/水=60/40,流速0.6ml/min。
用HPLC建立Gem浓度的标准曲线。
如图11所示,得到Gem的标准曲线为:y=0.366x+0.724,R
表1 S-Gem与TrxR相互作用后释放出Gem的浓度
如图12所示,由于TCEP是一种还原能离较强的试剂,当100M的S-Gem与1mM的TCEP共同孵育4h后,结果显示能够释放出96.93M的Gem,说明S-Gem中的二硫键断开之后确实能够释放出Gem。而100M的C-Gem与1mM的TCEP共同孵育4h后,几乎不能释放出Gem,证明了S-Gem中1,2-二硫戊烷片段对药物释放的重要性。而S-Gem与TrxR共同孵育,随着孵育时间的增加,释放出的Gem也随之增加,说明S-Gem能够通过TrxR达到缓释的效果。而S-Gem只与单独的NADPH或GSH孵育,也几乎不能释放出Gem,说明了S-Gem释放出Gem这一过程对TrxR具有非常好的专一性。
实验例5
本实验例测定实施例2合成的S-Gem对细胞的毒性。
本实验中分别选取了人宫颈癌细胞系Hela细胞、人肝癌细胞系SMMC-7721细胞、人肺癌细胞系A549细胞这三种不同类型的癌细胞来评估前药分子的生物活性,并构建TrxR1低表达的Hela细胞(Hela-shTrxR1)和转入空质粒的对照细胞Hela-shNT,来评估细胞内TrxR的表达水平对S-Gem生物活性的影响。细胞在含有10%FBS、2mM谷氨酰胺和100单位的青霉素和链霉素的DMEM培养基中,置于含有5%CO2,湿度97%和37℃的条件下培养。于96孔板中,每孔加入2500个细胞,培养12h待细胞贴壁后,分别用不同浓度的S-Gem、C-Gem和Gem处理细胞,继续培养96h,用MTT法测定细胞毒活。
结果如图13、图14、图15和图16所示,实验结果显示C-Gem对三种癌细胞几乎没有细胞毒性,说明C-Gem在细胞内不能释放出Gem。在三种癌细胞中,S-Gem发挥药效的时间明显要比Gem滞后,说明S-Gem具有缓释的功效。而在Hela-shNT和Hela-shTrxR1这一组细胞中,由于Hela-shTrxR1细胞中TrxR的表达量降低,S-Gem释放出Gem的速率降低,表现出的现象是S-Gem对Hela-shTrxR1具有较小的细胞毒活性。这些实验结果说明了S-Gem在多种肿瘤细胞中都具有缓释的效果,而且S-Gem对于TrxR表达量较小的细胞毒活较小,体现了S-Gem具有很好的选择性。
综上所述,本发明实施例提供了一种抗癌前药分子的靶向化合物,该靶向化合物能够被肿瘤细胞内过度表达的蛋白选择性识别;一种抗癌前药分子的制备方法,将前述的靶向化合物连接到抗癌活性分子的氨基或者羟基上,通过本方法将靶向化合物与抗癌活性分子连接,制得抗癌前药分子;在靶向化合物被肿瘤细胞内高表达的蛋白选择性识别后,释放出抗癌活性分子,直接作用于癌症细胞,达到靶向治疗的目的。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
一种抗癌前药分子及其制备方法与靶向化合物专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0