专利摘要
本发明公开了一种噻唑橙类菁染料分子及其应用。该染料分子的结构包括:结合基团、酶标基团、交联基团以及连接部位。该分子用于细胞荧光染色以及基于细菌内酯酶活性判断细菌的生存状态,选择性抑制死细菌DNA在PCR反应中的扩增,从而达到对活细菌快速定量检测的目的。本发明染料分子结构简单,制备成本低,而且酯酶降解率高。
权利要求
1.一种噻唑橙类菁染料分子,其特征在于,分子结构如下:
R为C2~C5的烷基。
2.根据权利要求1所述的噻唑橙类菁染料分子,其特征在于,分子结构为:
3.权利要求1或2所述噻唑橙类菁染料分子的应用,其特征在于,该分子用于活菌含量的检测。
4.权利要求1或2所述噻唑橙类菁染料分子的应用,其特征在于,该分子用于对细胞进行快速荧光染色。
说明书
技术领域
本发明涉及一种用于活细菌检测的分子的结构设计及其在细菌检测技术中的应用。本发明涉及的噻唑橙类菁染料分子(简称BOMA)能应用于细胞染色、细菌检测技术领域,利用细胞内酯酶活性是否存在作为判断细菌生存状态的依据,通过在荧光定量PCR反应中抑制死细菌的DNA扩增,达到定量检测样本中活细菌含量的目的。
背景技术
食源性致病菌是引起食源性疾病的主要因素之一,在世界食品安全领域中备受关注。而在自然环境中,微生物以多种生理状态存在:可培养的活菌,处于非可培养状态的活菌(Viable but Nonculturable,VBNC),具有完整结构但无生物活性的死菌(“Ghosts”)以及膜损伤死菌。只有“活菌”才保留有原菌的毒力和致病性,对食品安全造成潜在的威胁,而经过高温、紫外线等各种途径灭活处理的细菌已丧失了其致病性,因此食源性致病菌检验的关键是食品中“活”的致病菌是否存在和准确定量。
目前用于区别活菌和死菌的标准主要有:是否可培养,是否有代谢活性以及细胞膜是否完整。分离培养法对于活的非可培养状态的细菌会出现漏检。现有活菌PCR技术(EMA/PMA-qPCR活菌检测技术)实际上是通过细胞的膜的完整性来对“死”、“活”细胞进行区分检测。该活菌检测技术是利用新型核酸染料EMA(叠氮溴化乙锭)或PMA(叠氮溴化丙锭)渗入膜损伤的细胞后,与DNA发生共价结合,从而抑制膜损伤细胞DNA在PCR反应中的扩增。该方法利用EMA/PMA分子中的溴化乙锭、溴化丙锭不能穿透细胞膜的特性,选择性对膜损伤细胞的DNA进行结合,之后在可见光的作用下,使交联基团与DNA发生共价交联,达到在PCR反应中抑制被交联的DNA扩增的效果。然而细胞膜损伤可能是细胞死亡的一种极端表现形式,以细胞膜的完整性作为区分死、活菌的检测标准存在缺陷。首先,理论上EMA/PMA不能进入活的细胞内,但对一些具有可逆性的部分膜损伤细胞(如存在于环境样本中的细菌)以及部分膜完整的活菌,染料仍会穿透细胞膜,造成不同程度的活菌DNA损失,产生假阴性结果。其次某些灭菌方法不直接作用于细胞膜,如紫外线灭菌法,冷冻灭菌等。这种情况下,不能采用基于EMA或PMA的活菌PCR方法来评估灭菌方法的效果,否则会造成活细胞数目的严重高估。因此,以细胞膜的完整性作为区分活菌和死菌的检测标准仍有缺陷,而基于生物代谢活性的活菌分析将克服PMA-qPCR方法在原理上的不足,能直接通过细胞内代谢活性的有无对死、活细菌加以区分。尽管少数死亡细胞仍会残留微量的代谢活性,但在绝大多数情况下,这种活性丧失的速度快于膜的损伤,或大致相等。因此,建立一套基于生物代谢活性的活菌分析方法,使其既可有效检测出活菌(包括VBNC菌),又可克服原有活菌检测技术方法在原理上的不足,对于膜完整或膜损伤的死细胞不检测,同样符合致病菌检测的根本要求。
发明内容
本发明目的是提供一种基于细菌酯酶活性检测活细菌的噻唑橙类菁染料分子。
本发明另一目的是提供该种分子的应用。
本发明是一种用于活细菌检测技术的噻唑橙类菁染料分子结构及其在活细菌检测中应用。该分子结构将噻唑橙类染料从分子探针的设计、应用,拓展到用于活细菌检测的分子设计、应用。应用该分子结构设计的分子可用于细胞染色及细菌检测技术领域,通过利用该分子自由穿透细胞膜的特性,通过细胞内酯酶活性判断细菌生存状态,以及在荧光定量PCR反应中对死细菌DNA扩增的抑制作用,达到定量检测活细菌含量的目的。
一种噻唑橙类菁染料分子,分子结构如下:
R为C2~C5的烷基。
具体分子结构为:
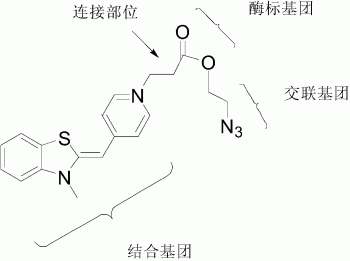
该分子结构包括:结合基团、酶标基团、交联基团,以及连接部位四部分。以连接部位R为C2的烷基为例,上述基团位置如图1所示。
上述噻唑橙类菁染料分子用于活菌含量的检测以及对细胞进行快速荧光染色。
本发明通过下列步骤实施:
根据化学反应式
化合物I’由化合物I与叠氮乙醇反应得到;反应在如下溶剂中进行:N,N-二环己基碳二酰亚胺、N,N-二甲基甲酰胺或上述溶剂的混合溶剂;反应中需加入碱作催化剂如4-二甲氨基吡啶;通常反应从0℃到30℃;反应时间约需1到24小时;反应完成后一般用乙醚提取收集,经干燥后得到化合物I’;得到的产物用NMR等方法来证明。
化合物I”由化学物I’与3-甲基-2-甲巯基苯并噻唑反应得到:反应在三乙醇胺下进行:通常反应温度从0℃到30℃,一般在室温下进行,反应时间约需1到36小时;反应完成后一般用乙醚进行提取收集,乙醚、乙醇的混合溶剂洗涤,经干燥后得到化合物I”;得到的产物用NMR等方法来证明。
本发明涉及的噻唑橙类菁染料分子的结构通过连接部位将交联基团、酶标基团和结合基团连接起来,形成一种可自由穿透细胞膜、对酯酶活性敏感、具有DNA交联作用的分子。结合基团的作用是使分子可以自由穿透细胞膜,故分子能够进入所有细胞。酶标基团中的酯键的一端与交联基团相连,另一端通过连接部位与DNA结合基团连接起来。由于酶标基团中的酯键对生物酯酶活性敏感,在酯酶水解作用下,酯键断裂,结合基团与交联基团可相互分离。这也是本发明涉及的分子结构的关键部分。交联基团在光照下与核酸共价结合后可抑制核酸在PCR反应中的扩增。在活性细胞内,当分子中的酯键被酶解断裂时,交联基团从分子上脱落;反之,在无活性的细胞内,交联基团不会脱落,在可见光的作用下与DNA共价交联形成共价化合物,抑制DNA后续扩增。而多余的游离状态的分子,其交联基团因在可见光作用下与水反应生成羟胺而被钝化。因此,将以本发明提供的结构设计出来的分子与定量PCR技术联合起来,建立新型活菌检测技术来区分活、死菌将依赖于细胞体内的酯酶活性,而不是细胞膜完整性,将可比以往的活菌检测技术更准确地检测出活菌含量。
本发明具有如下优点和有益效果:
(1)本发明设计了一种用于细胞染色、活细菌检测的BOMA分子。试验表明,BOMA分子能有效穿透细菌壁膜,并与核酸有良好的结合能力;用脂肪酶对BOMA进行水解,水解率高达95%,说明该分子的酯键能在相关酶作用下断裂;通过与实时荧光定量PCR联用,该分子对细菌DNA扩增具有明显的抑制作用。试验结果表明,BOMA分子的细胞膜穿透性、酯酶敏感性及对DNA的PCR扩增的抑制功能均可实现,因此能应用该分子进行细胞荧光染色以及对活细菌进行检测,利用细胞内酯酶活性是否存在判断细菌生存状态,通过在荧光定量PCR反应中抑制死细菌的核酸扩增,达到定量检测样本中活细菌含量的目的。
(2)与现有技术对比,在不影响分子结合基团功能的前提下,本发明去掉了结合基团中的一个苯环结构,使BOMA制备方法更为简便,合成成本降低。可见,改良后的BOMA分子,不但保留了原有分子关键功能特性,制备成本更低,制备方法更简便,而且酯酶降解率高;连接部位为C5烷基的噻唑橙类菁染料分子(BOMA-5)脂肪酶降解率为92%,尤其是连接部位为C2烷基的噻唑橙类菁染料分子(BOMA-2)脂肪酶降解率提高到95%。
(3)分子结构改进后的BOMA从合成技术上分析,(连接部位)烷基长度从C5缩短为C2结构,能大大降低分子在合成过程中产生同分异构体的几率,从而提高得率,降低制备过程中因同分异构体造成的损耗。
(4)与现有技术相比,BOMA分子不但能对死、活细胞进行快速荧光染色,而且应用BOMA-qPCR法通过细菌内酯酶活性的有无对活菌数量进行快速定量检测,因而能避免传统培养法耗时长、对VBNC菌发生漏检的情况以及PMA-qPCR法由于通过细胞膜完整性定量检测活菌而出现的假阳性、假阴性结果。
附图说明
图1是连接部位为C2烷基且标注各基团位置的噻唑橙分子(简称BOMA-2分子)的化学结构式。
图2是用10μg/mL浓度的BOMA-2分子与大肠杆菌O157:H7混合孵育10min后的荧光显微镜图像。
图3是BOMA-2分子的降解率随脂肪酶用量的变化情况。
图4是不同使用浓度的BOMA-2对金黄色葡萄球菌、大肠杆菌O157以及单增李斯特菌DNA在PCR反应中扩增的抑制作用,柱形图从左到右分别代表金黄色葡萄球菌、大肠杆菌O157及单增李斯特菌的DNA。
图5是经过BOMA-2和没有经过BOMA-2处理的大肠杆菌活菌DNA的PCR反应结果。
图6是经过BOMA-2和没有经过BOMA-2处理的大肠杆菌死菌DNA的PCR反应结果。
图7是经过BOMA-2和没有经过BOMA-2处理的混合大肠杆菌DNA的PCR反应结果。
图8是BOMA-5分子的降解率随脂肪酶用量的变化情况。
图9是不同使用浓度的BOMA-5对金黄色葡萄球菌、大肠杆菌O157以及单增李斯特菌DNA在PCR反应中扩增的抑制作用,柱形图从左到右分别代表金黄色葡萄球菌、大肠杆菌O157及单增李斯特菌的DNA。
具体实施方式
下面实施例说明应用本发明所涵盖的分子结构设计、制备出BOMA分子及对其应用作进一步的描述,但这里仅仅是举例说明,并不限制本发明。下列实施例中未注明具体条件的实验方法,通常按照常规条件,如过滤、旋转蒸发、纯化柱纯化等。
实施例1
一种噻唑橙类菁染料分子(BOMA-2),其制备方法如下:
总化学反应式为
具体制备步骤如下:
化合物2的制备:
1.50g化合物1与2.00g溴乙酸混合,120℃加热5小时。反应完温度降至室温后,得到的棕色固体用甲醇溶解后真空浓缩。浓缩后的物质用20mL二氯甲烷溶解并冷却到0℃。缓慢滴加40mL丙酮,过滤收集固体。分别用15mL丙酮洗涤三次,得到粗物质用20mL二氯甲烷重悬并搅拌30分钟。过滤收集固体,分别用15mL二氯甲烷洗涤三次,得到浅灰色固体1.32g,产率39%。
化合物3的制备:
1.30g化合物2与二氯甲烷、4-二甲氨基吡啶搅拌均匀后,冰浴下加入适量N,N-二环己基碳三酰亚胺搅拌均匀。加入80mL叠氮乙醇,室温反应24小时后,过滤收集产物。将产物旋转蒸发至糊状后,加入乙酸乙酯,于冰箱冷冻放置48小时,除去不溶物。柱纯化后,得到浅灰色固体1.13g,产率56%。
化合物4(BOMA-2)的制备:
1.13g化合物3与1.00g3-甲基-2-甲巯基苯并噻唑溶解在10mL二氯甲烷,加入948μL三乙胺,反应后得到黄色混合物,在室温下搅拌24小时。向混合物中缓慢滴加乙醚50mL,过滤收集固体。分别用15mL乙醚洗涤三次,得到粗物质。用75mL1:2(v:v)的乙醇:乙醚混合物重悬,搅拌1小时。过滤收集固体后分别用15mL乙醚洗涤三次。再用75mL1:2(v:v)的乙醇:乙醚混合溶剂重新溶解固体,搅拌1小时,过滤收集固体后分别用15mL乙醚洗涤三次,得到黄色固体0.78g,产率49%。
BOMA-2分子结构如图1所示,其相对分子质量为382。BOMA常温下为黄色固体,微溶于水,易溶于二甲基亚砜等有机溶剂。其核磁共振的氢谱化学位移如下:1H-NMR(600MHz,d6-DMSO):δ2.21-2.28(t,2H,CH2),3.19-3.26(t,2H,CH2),3.82-3.87(s,3H,CH3),3.98-4.03(t,2H,CH2),4.38-4.43(t,2H,CH2),6.75-6.79(s,1H,CH=),7.19-7.23(d,1H,Ar-H),7.46-7.52(t,1H,Ar-H),7.57-7.60(d,1H,Ar-H),7.69-7.75(t,1H,Ar-H),7.79-7.83(d,1H,Ar-H),7.87-7.90(d,1H,Ar-H),8.36-8.39(d,1H,Ar-H),8.55-8.61(d,1H,Ar-H)。
BOMA-2分子与大肠杆菌、金黄色葡萄球菌、单增李斯特菌等细菌的结合实验:
(1)BOMA-2对细菌胞膜的穿透性
取50mg BOMA粉末溶解于1mL20%(v/v)二甲基亚砜(DMSO)中得到浓度为50mg/mL的储备液。向90μL无菌超纯水中加入10μL BOMA-2储备液,混匀,得到5mg/mL BOMA-2工作液。
取500μL新鲜培养的大肠杆菌O157:H7菌液于1.5mL离心管中,6000rpm离心3分钟,等体积无菌水重悬。菌液中加入BOMA工作液1μL使菌液中BOMA-2终浓度为10μg/mL,充分混匀后,于室温下暗处孵育10分钟。将离心管水平放置于冰上,于650W的卤钨灯下方20cm处进行5分钟光照,期间轻轻摇晃冰盒保证溶液得到充分照射。
对经BOMA-2处理后的菌体使用10%(v/v)福尔马林缓冲液进行固定。吸取5μL固定完毕的菌液,滴在无自发荧光的载玻片中央,加入甘油封片剂,盖上盖玻片后使用透明指甲油封闭。制成样本后用激光共聚焦显微镜观察(激发波长455nm,发射波长490nm,100×油镜)。
经BOMA处理后的菌体均被染色,在激发光下发出强烈荧光,证实BOMA-2能穿透细胞膜进入细菌体内,能对细胞进行快速荧光染色,结果如图2所示。
(2)BOMA-2对脂肪酶敏感性
酶处理条件:0.212mg/mL BOMA溶液5mL(2.5μmoL),40℃水浴中预热2分钟,脂肪酶(固定化脂肪酶Novozym435,丹麦诺唯信公司)用量0.5~3.5U,充分混匀后40℃、150r/min黑暗下处理20分钟。滤膜过滤,滤液用于高效液相色谱(HPLC)分析检测水解后产物(避光)。HPLC条件:色谱柱采用Zorbax SB-C18柱(4.6mm×250mm,5μm);流动相为水:乙腈=60:40(v/v)的磷酸盐缓冲液(0.02mol/L,pH值6.99~7.01);柱温30℃;流量1mL/分钟;进样量10μL;采用PDA检测器,激发波长455nm,发射波长490nm。对照组中,使用等浓度未经酶解的BOMA溶液代替酶解液。结果以降解率表示,计算公式如下:
降解率=(酶解前BOMA-2的含量(mg/mL)-酶解后BOMA-2的含量(mg/mL))/对照组中BOMA的含量(mg/mL)×100%
BOMA-2在脂肪酶催化下,其水解率高达95%,说明BOMA-2分子对脂肪酶活性敏感,能在相应酶作用下快速水解,结果见图3。
(3)BOMA-2对DNA扩增的抑制作用
分别取500μL金黄色葡萄球菌、大肠杆菌O157:H7、单增李斯特菌菌液于1.5mL离心管中,6000rpm离心3分钟,收集菌体,等体积无菌水重悬。按照细菌基因组DNA快速提取试剂盒说明操作提取基因组DNA。分别向提取的3种细菌DNA中加入BOMA-2溶液使终浓度达到0、0.5、1.0、3.0、5.0、10.0、15.0、20.0μg/mL,充分混匀后于黑暗处静置5分钟,然后侧放于碎冰上,在卤钨灯下方约20cm处光照5分钟,使BOMA与DNA交联,同时钝化溶液中游离的BOMA-2分子。将经过光照处理的DNA溶液作为实时荧光定量PCR反应模板,考察BOMA-2对DNA扩增的抑制作用。
荧光定量PCR反应体系总体积为25μL,其中含10×Buffer2.5μL,25mmol/L Mg2+溶液3.5μL,25mmol/L dNTPs1μL,15μmol/L前后引物各1μL,10μmol/L探针1μL,模板溶液2μL,Taq DNA聚合酶2.5U,DEPC水12.5μL。反应条件:95℃预变性2分钟;95℃、5秒,60℃、40秒并收集荧光信号,进行40个循环(这里的循环是指从95℃、5秒至60℃、40秒收集荧光信号)。反应结束后40℃保温2分钟。每个荧光定量PCR反应各3次平行实验,计算平均Ct值(荧光信号达到设定的阈值所经历的循环数)和样本标准差SD值。
浓度为10μg/mL的BOMA-2对三种细菌的DNA的PCR反应扩增均有明显的抑制作用,结果见图4所示。
(4)BOMA-2检测样本中的活的大肠杆菌含量
分别取两份等浓度的新鲜培养的大肠杆菌菌液1.5mL于2毫升离心管中,无菌水洗涤菌体两次后以等体积无菌水重悬。将其中一份菌液置于100℃沸水浴中保温5分钟进行热灭活,得到大肠杆菌死菌菌液。分别取500μL活菌菌液、死菌菌液以及死、活菌比例为1:1的混合菌菌液各两份,向每种菌液中的其中一份加入5mg/mL的BOMA-2工作液1μL使菌液中BOMA-2终浓度为10μg/mL(另一份以无菌水代替BOMA工作液)。充分混匀后,于室温下暗处孵育10分钟。将离心管水平放置于冰上,于650W的卤钨灯下方20cm处进行5分钟光照,期间轻轻摇晃冰盒保证溶液得到充分照射。将经过BOMA-2处理和未经过BOMA-2处理的菌液在10000rpm离心5分钟,去上清。使用细菌基因组DNA提取试剂盒进行DNA提取。提取后的DNA作为荧光定量PCR反应模板。
荧光定量PCR反应体系总体积为25μL,其中含10×Buffer2.5μL,25mmol/L Mg2+溶液3.5μL,25mmol/L dNTPs1μL,15μmol/L前后引物各1μL,10μmol/L探针1μL,模板溶液2μL,Taq DNA聚合酶2.5U,DEPC水12.5μL。反应条件:95℃预变性2分钟;95℃、5秒,60℃、40秒并收集荧光信号,进行40个循环。反应结束后40℃保温2分钟。
将经过10μg/mL BOMA-2处理以及未经过BOMA处理的大肠杆菌活菌进行DNA提取后,分别将纯化的DNA作为模板进行qPCR反应,结果如图5所示。
该结果表明,经过BOMA-2处理以及未经BOMA-2处理的大肠杆菌活菌DNA,其qPCR反应结果的Ct值(均为23)相当接近,说明BOMA-2不影响活细菌的DNA的PCR反应扩增,对活细菌的qPCR定量检测结果基本无影响。
将经过10μg/mL BOMA-2处理以及未经过BOMA-2处理的大肠杆菌死菌进行DNA提取后,分别将纯化的DNA作为模板进行qPCR反应,结果如图6所示。
该结果表明,未经BOMA-2处理的死菌DNA,在qPCR反应中能参与核酸扩增(Ct值约为23);而经过浓度为10μg/mL的BOMA-2处理后的死菌,其DNA在qPCR反应中无法参与扩增(无Ct值),说明BOMA能抑制死菌的DNA在PCR反应中的扩增。
将经过10μg/mL BOMA-2处理以及未经过BOMA-2处理的大肠杆菌死菌进行DNA提取后,分别将纯化的DNA作为模板进行qPCR反应,结果如图7所示。
该结果显示,未经BOMA-2处理的混合菌样本,其检测结果Ct值为23,检测结果中反映了样本中死菌与活菌的总DNA含量;而经过BOMA-2处理的混合菌样本,其检测结果的Ct值为26(与未经BOMA处理样本Ct值相比,ΔCt=3),说明通过BOMA-2处理后,能够在死菌背景下对样本中的活菌进行定量检测,达到区别检测活菌的目的。
实施例2
一种噻唑橙类菁染料分子(BOMA-5),其制备方法如下:
化合物2的制备:
1.50g化合物1与2.26g6-溴己酸混合,120℃加热5小时。反应完温度降至室温后,得到的棕色固体用甲醇溶解后真空浓缩。浓缩后的物质用20mL二氯甲烷溶解并冷却到0℃。缓慢滴加40mL丙酮,过滤收集固体。分别用15mL丙酮洗涤三次,得到粗物质用20mL二氯甲烷重悬并搅拌30分钟。过滤收集固体,分别用15mL二氯甲烷洗涤三次,得到浅灰色固体1.44g,产率41%。
化合物3的制备:
1.4g化合物2与二氯甲烷、4-二甲氨基吡啶搅拌均匀后,冰浴下加入适量N,N-二环己基碳三酰亚胺搅拌均匀。加入80mL叠氮乙醇,室温反应24小时后,过滤收集产物。将产物旋转蒸发至糊状后,加入乙酸乙酯,于冰箱冷冻放置48小时,除去不溶物。柱纯化后,得到浅灰色固体0.94g,产率52%。
化合物4(BOMA-5)的制备:
0.94g化合物3与1.00g3-甲基-2-甲巯基苯并噻唑溶解在10mL二氯甲烷,加入948μL三乙胺,反应后得到黄色混合物,在室温下搅拌24小时。向混合物中缓慢滴加乙醚50mL,过滤收集固体。分别用15mL乙醚洗涤三次,得到粗物质。用75mL1:2(v:v)的乙醇:乙醚混合物重悬,搅拌1小时。过滤收集固体后分别用15mL乙醚洗涤三次。再用75mL1:2(v:v)的乙醇:乙醚混合溶剂重新溶解固体,搅拌1小时,过滤收集固体后分别用15mL乙醚洗涤三次,得到黄色固体0.65g,产率47%。
BOMA-5分子的相对分子质量为424,常温下为黄色固体,微溶于水,易溶于二甲基亚砜等有机溶剂。其核磁共振的氢谱化学位移如下:1H-NMR(600MHz,d6-DMSO):δ1.23-1.35(m,2H,CH2),1.42-1.51(m,2H,CH2),1.73-1.77(m,2H,CH2),2.16-2.25(t,2H,CH2),3.25-3.30(t,2H,CH2),3.85-3.91(s,3H,CH3),4.03-4.07(t,2H,CH2),4.43-4.49(t,2H,CH2),6.80-6.84(s,1H,CH=),7.23-7.27(d,1H,Ar-H),7.51-7.57(t,1H,Ar-H),7.60-7.63(d,1H,Ar-H),7.74-7.80(t,1H,Ar-H),7.83-7.87(d,1H,Ar-H),7.91-7.94(d,1H,Ar-H),8.42-8.45(d,1H,Ar-H),8.62-8.66(d,1H,Ar-H)。
BOMA-5分子与大肠杆菌、金黄色葡萄球菌、单增李斯特菌等细菌的结合实验:
(1)BOMA-5对细菌胞膜的穿透性
取50mg BOMA-5粉末溶解于1mL20%(v/v)二甲基亚砜(DMSO)中得到浓度为50mg/mL的储备液。向90μL无菌超纯水中加入10μL BOMA-5储备液,混匀,得到5mg/mL BOMA-5工作液。
取500μL新鲜培养的大肠杆菌O157:H7菌液于1.5mL离心管中,6000r/min离心3分钟,等体积无菌水重悬。菌液中加入BOMA-5工作液1μL使菌液中BOMA-5终浓度为10μg/mL,充分混匀后,于室温下暗处孵育10分钟。将离心管水平放置于冰上,于650W的卤钨灯下方20cm处进行5分钟光照,期间轻轻摇晃冰盒保证溶液得到充分照射。
对经BOMA-5处理后的菌体使用10%(v/v)福尔马林缓冲液进行固定。吸取5μL固定完毕的菌液,滴在无自发荧光的载玻片中央,加入甘油封片剂,盖上盖玻片后使用透明指甲油封闭。制成样本后用激光共聚焦显微镜观察结果(激发波长455nm,发射波长490nm,100×油镜)。
(2)BOMA-5对脂肪酶敏感性
酶处理条件:0.212mg/mL BOMA-5溶液5mL(2.5μmoL),40℃水浴中预热2分钟,脂肪酶(固定化脂肪酶Novozym435,丹麦诺唯信公司)用量0.5~3.5U,充分混匀后40℃、150r/min黑暗下处理20分钟。滤膜过滤,滤液用于高效液相色谱(HPLC)分析检测水解后产物(避光)。HPLC条件:色谱柱采用Zorbax SB-C18柱(4.6mm×250mm,5μm);流动相为水:乙腈=60:40(v/v)的磷酸盐缓冲液(0.02mol/L,pH值6.99~7.01);柱温30℃;流量1mL/分钟;进样量10μL;采用PDA检测器,激发波长455nm,发射波长490nm。对照组中,使用等浓度未经酶解的BOMA-5溶液代替酶解液。结果以降解率表示,计算公式如下:
降解率=(酶解前BOMA-5的含量(mg/mL)-酶解后BOMA-5的含量(mg/mL))/对照组中BOMA-5的含量(mg/mL)×100%
BOMA-5在脂肪酶催化下,其水解率约为92%,说明BOMA-5分子对脂肪酶活性敏感,能在相应酶作用下快速水解,结果见图8。
(3)BOMA-5对DNA扩增的抑制作用
分别取500μL金黄色葡萄球菌、大肠杆菌O157:H7、单增李斯特菌菌液于1.5mL离心管中,6000r/min离心3分钟,收集菌体,等体积无菌水重悬。按照细菌基因组DNA快速提取试剂盒说明操作提取基因组DNA。分别向提取的3种细菌DNA中加入BOMA-5溶液使终浓度达到0、0.5、1.0、3.0、5.0、10.0、15.0、20.0μg/mL,充分混匀后于黑暗处静置5分钟,然后侧放于碎冰上,在卤钨灯下方约20cm处光照5分钟,使BOMA-5与DNA交联,同时钝化溶液中游离的BOMA-5分子。将经过光照处理的DNA溶液作为实时荧光定量PCR反应模板,考察BOMA-5对DNA扩增的抑制作用。
荧光定量PCR反应体系总体积为25μL,其中含10×Buffer2.5μL,25mmol/L Mg2+溶液3.5μL,25mmol/L dNTPs1μL,15μmol/L前后引物各1μL,10μmol/L探针1μL,模板溶液2μL,Taq DNA聚合酶2.5U,DEPC水12.5μL。反应条件:95℃预变性2分钟;95℃、5秒,60℃、40秒并收集荧光信号,进行40个循环(这里的循环是指从95℃、5秒至60℃、40秒收集荧光信号)。反应结束后40℃保温2分钟。每个荧光定量PCR反应各3次平行实验,计算平均Ct值(荧光信号达到设定的阈值所经历的循环数)和样本标准差SD值。
当BOMA-5的浓度达到10μg/mL时,三种细菌的DNA扩增开始受到明显的抑制作用,结果见图9所示。
一种噻唑橙类菁染料分子及其应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0