专利摘要
本发明涉及染料敏化太阳能电池领域,旨在提供一种蒽基稠环芳烃有机染料及其制备方法。该有机染料的分子结构式如式(I)所示。本发明提供的蒽基稠环芳烃有机染料是在构建的蒽基稠环芳烃上进行修饰辅助电子给体D和电子受体A,使得本发明制备得到的有机染料在应用于染料敏化太阳电池时,光电转化效率较高,而且本发明的有机染料的原材料来源广泛、成本低廉,且制备方法简单,可以实现工业化生产。
权利要求
1.一种蒽基稠环芳烃有机染料,其特征在于,该有机染料的分子结构式如式(I)所示:
式(I)中,R1-1、R1-2、R1-3和R1-4独立地选自H、C1~C36烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
D为H、C6~C50芳基取代的胺基、C6~C50杂芳基取代的胺基、C6~C50芳基取代的不饱和烃基、C6~C50杂芳基取代的不饱和烃基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
A为式(A1):
式(A1)中,x、y和z独立地选自0或1。
2.根据权利要求1所述的有机染料,其特征在于,在所述式(I)中,R1-1、R1-2、R1-3和R1-4独立地选自C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基。
3.根据权利要求1所述的有机染料,其特征在于,在所述式(I)中,D为式(D1)、式(D2)、式(D3)、(D4)、式(D5)、式(D6)或式(D7):
其中,Ra-1-1、Ra-1-2、Ra-2-1、Ra-2-2、Ra-3-1、Ra-3-2、Ra-4-1、Ra-4-2、Ra-5-1、Ra-5-2、Ra-6-1和Ra-6-2独立地选自H、C1~C36烷基或C1~C36烷氧基;
Ra-3-3、Ra-3-4、Ra-6-3和Ra-6-4独立的选自H、C1~C36的烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
Ra-2-3、Ra-2-4、Ra-2-5、Ra-2-6、Ra-5-3、Ra-5-4、Ra-5-5和Ra-5-6独立地选自H、C1~C36烷基、C1~C36烷氧基取代的苯基或C1~C36烷基取代的苯基;
Ra-7-1选自H、C1~C36烷基或C1~C36烷氧基;
z为0或1。
4.根据权利要求3所述的有机染料,其特征在于,
Ra-1-1、Ra-1-2、Ra-2-1、Ra-2-2、Ra-3-1、Ra-3-2、Ra-4-1、Ra-4-2、Ra-5-1、Ra-5-2、Ra-6-1和Ra-6-2独立地选自C6~C30烷基或C6~C30烷氧基;
Ra-3-3、Ra-3-4、Ra-6-3和Ra-6-4独立地选自C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基;
Ra-2-3、Ra-2-4、Ra-2-5、Ra-2-6、Ra-5-3、Ra-5-4、Ra-5-5和Ra-5-6独立地选自C6~C30烷基、C6~C30烷氧基取代的苯基或C6~C30烷基取代的苯基;
Ra-7-1选自C6~C30烷基或C6~C30烷氧基。
5.根据权利要求1所述的有机染料,其特征在于,所述有机染料具有式(I-1)或式(I-2)所示的结构:
6.权利要求1~5任意一项中所述的有机染料的制备方法,其特征在于,是将式(II)所示化合物与式(III)所示化合物,在碳碳键偶联条件下进行反应,得到式(I-1)或式(I-2)的化合物;
其中,式(II)为
式(II)中,X1为H、或卤素;D为H、C6~C50芳基取代的胺基、C6~C50杂芳基取代的胺基、C6~C50芳基取代的不饱和烃基、C6~C50杂芳基取代的不饱和烃基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;R1-1、R1-2、R1-3和R1-4独立地选自H、C1~C36烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
式(III)为:A;
A的结构如式(A1)所示:
式(A1)中,x、y和z独立地选自0或1。
7.根据权利要求6所述的制备方法,其特征在于,所述式(II)的化合物按照以下方法制备得到:
(1)将式(IV)所示的化合物,与式(D1)、式(D2)、式(D3)、(D4)、式(D5)、式(D6)或式(D7)所示的化合物混合后,在碳氮键或碳碳键偶联条件下反应,然后再进行卤化反应,得到式(II)的化合物;
式(IV)中,X2独立地选自卤素;R1-1、R1-2、R1-3和R1-4独立地选自C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基;
式(D1)、式(D2)、式(D3)、(D4)、式(D5)、式(D6)或式(D7)的结构如下所示:
其中,Ra-1-1、Ra-1-2、Ra-2-1、Ra-2-2、Ra-3-1、Ra-3-2、Ra-4-1、Ra-4-2、Ra-5-1、Ra-5-2、Ra-6-1和Ra-6-2独立地选自H、C1~C36烷基或C1~C36烷氧基;
Ra-3-3、Ra-3-4、Ra-6-3和Ra-6-4独立的选自H、C1~C36的烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
Ra-2-3、Ra-2-4、Ra-2-5、Ra-2-6、Ra-5-3、Ra-5-4、Ra-5-5和Ra-5-6独立地选自H、C1~C36烷基、C1~C36烷氧基取代的苯基或C1~C36烷基取代的苯基;
Ra-7-1选自H、C1~C36烷基或C1~C36烷氧基;
z为0或1。
8.根据权利要求7所述的制备方法,其特征在于,所述式(IV)的化合物按照以下方法制备得到:
(1)将式(V)的化合物和式(VI)的化合物混合后,在碳碳键偶联条件下反应,得到式(VII)的化合物;
其中,
式(V)中,R2-1独立地选自Sn(CH3)3-、Sn(n-Bu)3-或硼酸酯基;
式(VI)中,R3-1和R4-1独立地选自C1~C8烷基,X3和X4独立地选自Cl、Br或I;
(2)在亲核加成条件下,将式(VII)的化合物转化为式(VIII)的化合物:
然后以大孔强酸性磺酸型聚合物树脂进行芳基化反应,将式(VIII)的化合物转化为式(IV)的化合物。
说明书
技术领域
本发明涉及染料敏化太阳能电池领域,尤其涉及一种蒽基稠环芳烃有机染料及其制备方法。
背景技术
太阳能作为一种可再生清洁能源,对其进行低成本高效率的开发利用成为当今的重要任务。染料敏化太阳能电池作为太阳能电池的重要一种已得到世界的广泛关注。1991年, 研究组将Amadelli等人报道过的三核钌染料RuL2(μ-(CN)Ru(CN)L′2)2(L为2,2′-联吡啶-4,4′-二羧酸,L′=2,2′-联吡啶)作为敏化剂吸附在他们多年潜心发展的高质量TiO2纳晶薄膜上制成器件,获得了模拟太阳光下7.1%的光电转换效率,由此开启了染料敏化太阳电池的研究大幕。与传统的无机半导体太阳能电池相比,染料敏化太阳电池的制造成本较低,且颜色丰富、美观,可制成半透明的产品,柔性的染料敏化太阳电池重量较轻,可以折叠、卷曲可以广泛应用于日常生活中。
染料敏化太阳电池通常由透明基底层、导电层、半导体微纳粒子层、有机染料层、空穴输运层和对电极组成,其中,有机染料层是染料敏化太阳电池的核心。目前,可以用于商业化太阳能电池的染料均为含有贵金属钌的配合物,但是由于钌资源缺乏,因此使钌系材料的成本高昂,严重制约了大规模的生产应用,纯有机染料已是大势所趋。所以开发高效低成本的有机染料是本领域的研究核心,是实现染料敏化太阳能电池产业发展的重要部分。
发明内容
本发明所要解决的技术问题是,克服现有技术中的不足,提供一种蒽基稠环芳烃有机染料及其制备方法。该有机染料不仅制备方法简单,而且当用于太阳能电池时光电转化效率较高。
本发明提供了一种蒽基稠环芳烃有机染料,该有机染料的分子结构式如式(I)所示:
式(I)中,R1-1、R1-2、R1-3和R1-4独立地选自H、C1~C36烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
D为H、C6~C50芳基取代的胺基、C6~C50杂芳基取代的胺基、C6~C50芳基取代的不饱和烃基、C6~C50杂芳基取代的不饱和烃基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
A为式(A1):
式(A1)中,x、y和z独立地选自0或1。
作为本发明的优选方案,在所述式(I)中,R1-1、R1-2、R1-3和R1-4独立地选自C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基。
本发明中,在所述式(I)中,D为式(D1)、式(D2)、式(D3)、(D4)、式(D5)、式(D6)或式(D7):
其中,Ra-1-1、Ra-1-2、Ra-2-1、Ra-2-2、Ra-3-1、Ra-3-2、Ra-4-1、Ra-4-2、Ra-5-1、Ra-5-2、Ra-6-1和Ra-6-2独立地选自H、C1~C36烷基或C1~C36烷氧基;
Ra-3-3、Ra-3-4、Ra-6-3和Ra-6-4独立的选自H、C1~C36的烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
Ra-2-3、Ra-2-4、Ra-2-5、Ra-2-6、Ra-5-3、Ra-5-4、Ra-5-5和Ra-5-6独立地选自H、C1~C36烷基、C1~C36烷氧基取代的苯基或C1~C36烷基取代的苯基;
Ra-7-1选自H、C1~C36烷基或C1~C36烷氧基;
z为0或1。
作为本发明的优选方案,Ra-1-1、Ra-1-2、Ra-2-1、Ra-2-2、Ra-3-1、Ra-3-2、Ra-4-1、Ra-4-2、Ra-5-1、Ra-5-2、Ra-6-1和Ra-6-2独立地选自C6~C30烷基或C6~C30烷氧基;
Ra-3-3、Ra-3-4、Ra-6-3和Ra-6-4独立地选自C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基;
Ra-2-3、Ra-2-4、Ra-2-5、Ra-2-6、Ra-5-3、Ra-5-4、Ra-5-5和Ra-5-6独立地选自C6~C30烷基、C6~C30烷氧基取代的苯基或C6~C30烷基取代的苯基;
Ra-7-1选自C6~C30烷基或C6~C30烷氧基。
本发明中,所述有机染料具有式(I-1)或式(I-2)所示的结构:
本发明进一步提供了前述有机染料的制备方法,是将式(II)所示化合物与式(III)所示化合物,在碳碳键偶联条件下进行反应,得到式(I-1)或式(I-2)的化合物;
其中,式(II)为
式(II)中,X1为H、或卤素;D为H、C6~C50芳基取代的胺基、C6~C50杂芳基取代的胺基、C6~C50芳基取代的不饱和烃基、C6~C50杂芳基取代的不饱和烃基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;R1-1、R1-2、R1-3和R1-4独立地选自H、C1~C36烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
式(III)为:A;
A的结构如式(A1)所示:
式(A1)中,x、y和z独立地选自0或1。
本发明中,所述式(II)的化合物按照以下方法制备得到:
(1)将式(IV)所示的化合物,与式(D1)、式(D2)、式(D3)、(D4)、式(D5)、式(D6)或式(D7)所示的化合物混合后,在碳氮键或碳碳键偶联条件下反应,然后再进行卤化反应,得到式(II)的化合物;
式(IV)中,X2独立地选自卤素;R1-1、R1-2、R1-3和R1-4独立地选自C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基;
式(D1)、式(D2)、式(D3)、(D4)、式(D5)、式(D6)或式(D7)的结构如下所示:
其中,Ra-1-1、Ra-1-2、Ra-2-1、Ra-2-2、Ra-3-1、Ra-3-2、Ra-4-1、Ra-4-2、Ra-5-1、Ra-5-2、Ra-6-1和Ra-6-2独立地选自H、C1~C36烷基或C1~C36烷氧基;
Ra-3-3、Ra-3-4、Ra-6-3和Ra-6-4独立的选自H、C1~C36的烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
Ra-2-3、Ra-2-4、Ra-2-5、Ra-2-6、Ra-5-3、Ra-5-4、Ra-5-5和Ra-5-6独立地选自H、C1~C36烷基、C1~C36烷氧基取代的苯基或C1~C36烷基取代的苯基;
Ra-7-1选自H、C1~C36烷基或C1~C36烷氧基;
z为0或1。
本发明中,所述式(IV)的化合物按照以下方法制备得到:
(1)将式(V)的化合物和式(VI)的化合物混合后,在碳碳键偶联条件下反应,得到式(VII)的化合物;
其中,
式(V)中,R2-1独立地选自Sn(CH3)3-、Sn(n-Bu)3-或硼酸酯基;
式(VI)中,R3-1和R4-1独立地选自C1~C8烷基,X3和X4独立地选自Cl、Br或I;
(2)在亲核加成条件下,将式(VII)的化合物转化为式(VIII)的化合物:
然后以大孔强酸性磺酸型聚合物树脂进行芳基化反应,将式(VIII)的化合物转化为式(IV)的化合物。
与现有技术相比,本发明有益效果在于:
本发明提供的蒽基稠环芳烃有机染料是在构建的蒽基稠环芳烃上进行修饰辅助电子给体D和电子受体A,使得本发明制备得到的有机染料在应用于染料敏化太阳电池时,光电转化效率较高,而且本发明的有机染料的原材料来源广泛、成本低廉,且制备方法简单,可以实现工业化生产。
附图说明
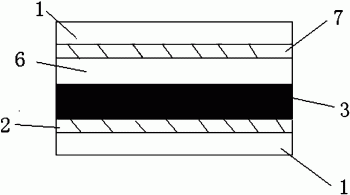
图1为本发明提供的染料敏化太阳能电池的结构示意图;
图2为本发明提供的染料敏化太阳能电池中的光吸收层的结构示意图;
图3为本发明提供的染料敏化太阳电池的制作工艺流程图。
图中各附图标记:1透明基底层;2导电层;3光吸收层;4半导体纳米粒子层(常用的是TiO2纳米晶薄膜);5染料层;6电解质层;7对电极(常用的是覆盖纳米铂的玻璃电极)。
具体实施方式
本发明提供了一种有机染料,其具有式(I)所示结构:
其中,
D为H、C6~C50芳基取代的胺基、C6~C50杂芳基取代的胺基、C6~C50芳基取代的不饱和烃基、C6~C50杂芳基取代的不饱和烃基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
A为式(A1)
其中,x、y和z独立地选自0或1。
R1-1、R1-2、R1-3和R1-4独立地选自H、C1~C36烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基。
在本发明中,术语“烷基”、“烷氧基”、“芳基”、“杂芳基”和“烃基”具有本领域技术人员所通常理解的含义。“碳氮键或碳碳键偶联条件下反应”、“卤化反应”、“亲核加成条件下转化”、“芳基化反应”等均为有机化学中熟知的反应方式,因属本领域技术人员熟练掌握的技术内容,故不再赘述。“大孔强酸性磺酸型聚合物树脂”是常见的有机合成催化剂,可选型号Amberlyst 15。
按照本发明,D优选为C12~C35芳基取代的胺基、C12~C35杂芳基取代的胺基、C12~C35芳基取代的不饱和烃基、C12~C35杂芳基取代的不饱和烃基、C5~C30烷基取代的苯基或C5~C30烷氧基取代的苯基,更优选为C18~C30芳基取代的胺基、C18~C30杂芳基取代的胺基、C18~C30芳基取代的不饱和烃基、C18~C30杂芳基取代的不饱和烃基、C10~C20烷基取代的苯基或C10~C20烷氧基取代的苯基。
最优选地,D为式(D1)、式(D2)、式(D3)、(D4)、式(D5)、式(D6)或式(D7):
其中,Ra-1-1、Ra-1-2、Ra-2-1、Ra-2-2、Ra-3-1、Ra-3-2、Ra-4-1、Ra-4-2、Ra-5-1、Ra-5-2、Ra-6-1和Ra-6-2独立地选自H、C1~C36烷基或C1~C36烷氧基;
Ra-3-3、Ra-3-4、Ra-6-3和Ra-6-4独立的选自H、C1~C36的烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
Ra-2-3、Ra-2-4、Ra-2-5、Ra-2-6、Ra-5-3、Ra-5-4、Ra-5-5和Ra-5-6独立地选自H、C1~C36烷基、C1~C36烷氧基取代的苯基或C1~C36烷基取代的苯基;
Ra-7-1选自H、C1~C36烷基或C1~C36烷氧基;
z为0或1。
按照本发明,Ra-3-3优选为C5~C30烷基,C5~C30烷基取代的苯基或C5~C330烷氧基取代的苯基,更优选为C7~C20烷基,C7~C20烷基取代的苯基或C7~C20烷氧基取代的苯基,最优选为C10~C15烷基,C10~C15烷基取代的苯基或C10~C15烷氧基取代的苯基;Ra-6-3优选为C5~C30烷基,C5~C30烷基取代的苯基或C5~C330烷氧基取代的苯基,更优选为C7~C20烷基,C7~C20烷基取代的苯基或C7~C20烷氧基取代的苯基,最优选为C10~C15烷基,C10~C15烷基取代的苯基或C10~C15烷氧基取代的苯基;Ra-6-4优选为C5~C30烷基,C5~C30烷基取代的苯基或C5~C330烷氧基取代的苯基,更优选为C7~C20烷基,C7~C20烷基取代的苯基或C7~C20烷氧基取代的苯基,最优选为C10~C15烷基,C10~C15烷基取代的苯基或C10~C15烷氧基取代的苯基。
Ra-1-1优选为C5~C30烷基或C5~C30烷氧基,更优选为C7~C20烷基或C7~C20烷氧基,最优选为C10~C15烷基或C10~C15烷氧基;Ra-2-1优选为C5~C30烷基或C5~C30烷氧基,更优选为C7~C20烷基或C7~C20烷氧基,最优选为C10~C15烷基或C10~C15烷氧基;Ra-3-1优选为C5~C30烷基或C5~C30烷氧基,更优选为C7~C20烷基或C7~C20烷氧基,最优选为C10~C15烷基或C10~C15烷氧基;Ra-4-1优选为C5~C30烷基或C5~C30烷氧基,更优选为C7~C20烷基或C7~C20烷氧基,最优选为C10~C15烷基或C10~C15烷氧基;Ra-5-1优选为C5~C30烷基或C5~C30烷氧基,更优选为C7~C20烷基或C7~C20烷氧基,最优选为C10~C15烷基或C10~C15烷氧基;Ra-5-2优选为C5~C30烷基或C5~C30烷氧基,更优选为C7~C20烷基或C7~C20烷氧基,最优选为C10~C15烷基或C10~C15烷氧基;Ra-6-1优选为C5~C30的烷基或C5~C30的烷氧基,更优选为C7~C20烷基或C7~C20烷氧基,最优选为C10~C15烷基或C10~C15烷氧基;Ra-6-2优选为C5~C30烷基或C5~C30烷氧基,更优选为C7~C20烷基或C7~C20烷氧基,最优选为C10~C15烷基或C10~C15烷氧基。
Ra-2-3优选为C5~C30烷基、C5~C30烷氧基取代苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基;Ra-2-4优选为C5~C30烷基、C5~C30烷氧基取代的苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基;Ra-2-5优选为C5~C30烷基、C5~C30烷氧基取代的苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基;Ra-2-6优选为C5~C30烷基、C5~C30烷氧基取代的苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基;Ra-5-3优选为C5~C30烷基、C5~C30烷氧基取代的苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基;Ra-5-4优选为C5~C30烷基、C5~C30烷氧基取代的苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基;Ra-5-5优选为C5~C30烷基、C5~C30烷氧基取代的苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基;Ra-5-6优选为C5~C30烷基、C5~C30烷氧基取代的苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基。
Ra-7-1优选为C5~C30烷基、C5~C30烷氧基取代的苯基或C5~C30烷基取代的苯基,更优选为C7~C20烷基、C7~C20烷氧基取代的苯基或C7~C20烷基取代的苯基,最优选为C10~C15烷基、C10~C15烷氧基取代的苯基或C10~C15烷基取代的苯基。
按照本发明,R1-1优选为C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基,更优选为C8~C20烷基、C8~C20烷基取代的苯基或C8~C20烷氧基取代的苯基,最优选为C10~C15烷基、C10~C15烷基取代的苯基或C10~C15烷氧基取代的苯基;R1-2优选为C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基,更优选为C8~C20烷基、C8~C20烷基取代的苯基或C8~C20烷氧基取代的苯基,最优选为C10~C15烷基、C10~C15烷基取代的苯基或C10~C15烷氧基取代的苯基;R1-3优选为C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基,更优选为C8~C20烷基、C8~C20烷基取代的苯基或C8~C20烷氧基取代的苯基,最优选为C10~C15烷基、C10~C15烷基取代的苯基或C10~C15烷氧基取代的苯基;R1-4优选为C6~C30烷基、C6~C30烷基取代的苯基或C6~C30烷氧基取代的苯基,更优选为C8~C20烷基、C8~C20烷基取代的苯基或C8~C20烷氧基取代的苯基,最优选为C10~C15烷基、C10~C15烷基取代的苯基或C10~C15烷氧基取代的苯基。
作为更具体地示例,有机染料具有式(I-1)或式(I-2)所示的结构:
本发明还提供了一种用于本发明的有机染料的制备方法,包括:
将式(II)的化合物与式(III)的化合物,在碳碳键条件下进行反应,得到式(I-1)或式(I-2)的化合物;
A式(III),
其中,D为H、C6~C50芳基取代的胺基、C6~C50杂芳基取代的胺基、C6~C50芳基取代的不饱和烃基、C6~C50杂芳基取代的不饱和烃基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
所述A为式(A1)
其中,x、y和z独立地选自0或1;
所述R1-1、R1-2、R1-3和R1-4独立地选自H、C1~C36烷基、C1~C36烷基取代的苯基或C1~C36烷氧基取代的苯基;
所述X1为Hr或卤素。
按照本发明的方法,将式(II)化合物与式(III)所示的化合物进行碳碳键偶联反应,得到式(I-1)或式(I-2)所示的化合物;本发明优选先用N-溴代丁二酰亚胺(NBS)对式(II)所示的化合物进行活化,然后将活化后的化合物与式(III)所示的化合物反应,得到式(I-1)或式(I-2)所示的化合物;其中,在将活化后的化合物与式(III)所示的化合物进行碳碳键偶联反应中,使用的催化剂优选为碳酸铯以及Pd2(dba)3和有机膦配体P(t-Bu)3混合的甲苯溶液。
其中,式(II)以及式(III)所示的化合物中的取代基的选择与上述有机染料中所述取代基的选择相同。
本发明的方法中,对原料的来源没有特殊限制,只要能够通过本领域公知的方法制备得到即可,其中式(II)所示的化合物优选按照以下方法制备得到,
将式(D1)、式(D2)、式(D3)、(D4)、式(D5)、式(D6)或式(D7)的化合物和式(IV)的化合物混合后,在碳氮键或碳碳键偶联条件下反应,再进行卤化反应得到式(II)的化合物;
X2独立地选自卤素;
按照本发明的方法,式(D1)至式(D7)的化合物中的任意一种与式(IV)的化合物混合并进行碳氮键或碳碳键偶联反应,再进行卤化反应得到式(II)的化合物;其中,本发明的方法对反应中各原料的用量没有严格限制,本领域技术人员可以根据实际需要选择合适的用量;在进行碳氮键或碳碳键偶联反应中使用的催化剂优选为三(二亚苄基丙酮)二钯和P(t-Bu)3或三(二亚苄基丙酮)二钯、2-二环己基磷-2',6'-二异丙氧基-1,1'-联苯(Ruphos));反应中使用的溶剂优选为甲苯或1,4-二氧六环;反应的温度优选为80~130℃。
其中,所述式(IV)的化合物按照以下方法制备得到,
1)式(V)的化合物和式(VI)的化合物混合并在碳碳键偶联条件下进行反应,得到式(VII)的化合物;
其中,R2-1独立地选自Sn(CH3)3-、Sn(n-Bu)3-或硼酸酯基,
R3-1和R4-1独立地选自C1~C8烷基,
X3和X4独立地选自Cl、Br或I;
2)在亲核加成条件下,将所述式(VII)的化合物转化为式(IV)的化合物。
按照本发明的方法,将式(V)的化合物和式(VI)的化合物混合并在碳碳键偶联条件下进行反应,得到式(VII)所示的化合物;其中,本发明的方法对反应中各原料的用量没有严格限制,本领域技术人员可以根据实际需要选择合适的用量;在碳碳键偶联反应中使用的催化剂优选醋酸钯Pd(OAc)2和有机膦配体2-双环己基膦-2',6'-二甲氧基联苯(Sphos);反应中使用的溶剂优选为甲苯或1,4-二氧六环或甲苯和水的混合溶剂或1,4-二氧六环和水的混合溶剂;反应的温度优选为120℃。
按照本发明的方法,将式(VII)的化合物转化为式(IV)所示的化合物,优选按照以下方法制备:
2-1)在亲核加成条件下,将所述式(VII)的化合物转化为式(VIII)的化合物:
2-2)将所述式(VIII)的化合物进行芳基化转化为式(IV)的化合物。
其中,本发明对步骤2-1)的亲核加成反应过程没有特殊要求,其可以通过本领域公知的亲核加成反应过程进行;步骤2-2)中芳基化所用的优选为大孔强酸性磺酸型聚合物树脂,更优选为固体酸催化剂Amberlyst 15。
本发明提供的有机染料是在构建的蒽基稠环芳烃上进行修饰辅助电子给体D和电子受体A,使得本发明制备得到的有机染料在应用于染料敏化太阳电池时,光电转化效率较高,而且本发明的有机染料的原材料来源广泛、成本低廉,且制备方法简单,可以实现工业化生产。
下面将进一步结合本发明实施例的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分示例性实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
式(I-1)的化合物的制备
反应历程1
式(XII)的化合物根据参考文献(Sakamoto,K.;Takashima,Y.;Hamada,N.;Ichida,H.;Yamaguchi,H.;Yamamoto,H.;Harada,A.Org.Lett.2011,4,672.)合成,对其路线进行了优化,大幅度提高了反应的产率,式(XIII)的化合物根据参考文献(Kawamorita,S.;Ohmiya,H.;Iwai,T.;Sawamura,M.Angew.Chem.Int.Ed.2011,50,8363.)合成,式(XVII)的化合物根据参考文献(Yao,Z.;Yan,C.;Zhang,M.;Li,R.;Cai,Y.;Wang,P.Adv.Energy Mater.2014,4,1400244.),三键苯甲酸丁酯根据参考文献(Pawle,R.H.;Eastman,V.;Thomas,III,S.W.J.Mater.Chem.2011,21,14041.)合成,其它制备染料过程中的原料化合物以及溶剂、催化剂的来源并无特殊限定,可以为一般市售,或者按照本领域公知的方法进行制备得到。
式(X)的化合物的合成:
在圆底烧瓶中,将10.0g式(IX)的化合物溶解在100mL乙醇中,然后滴加1.5mL浓硫酸,回流反应过夜。反应结束后,将反应体系降温至室温,加入30mL水,混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用乙酸乙酯/石油醚(沸程为60-90℃)(体积比1/20)作为展开剂柱层析,得到11.36g式(III)的化合物,收率98%。
核磁共振氢谱数据和参考文献中一致。
式(XI)结构的化合物的合成:
在干燥的Schlenk反应瓶中,将10g中间体(X)、5.40g双(频哪醇合)二硼和12.52g醋酸钾溶解在120mL二甲基亚砜中,在氩气氛围下加入1.56g催化剂Pd(dppf)Cl2,反应体系在氩气氛围下80℃反应8h。反应结束后,将反应体系降温至室温,加入30mL水,混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用二氯甲烷/石油醚(沸程为60-90℃)(体积比4/1)作为展开剂柱层析,得到10.56g式(XI)的化合物,收率为80%。
核磁共振氢谱数据和参考文献中一致。
式(XII)结构的化合物的合成:
在圆底烧瓶中加入10.0g中间体(XI)和120mL氯仿/三氟乙酸(体积比为5/1)的混合溶剂,缓慢加入12.04g N-溴代丁二酰亚胺。反应体系在室温下避光搅拌2h。加入30mL水,用氯仿(3×15mL)萃取三次,合并有机相,用无水硫酸钠干燥后过滤。浓缩滤液后得到的粗产物用二氯甲烷/石油醚(沸程为60-90℃)(体积比1/1)作为洗脱剂通过硅胶柱层析分离,得到10.86g式(XII)的化合物,收率为72%。
核磁共振氢谱数据和参考文献中一致。
式(XIV)结构的化合物的合成:
在三颈圆底烧瓶中,将3.1g式(XII)的化合物、5.0g式(XIII)的化合物溶解在30mL二氧六环/水的混合溶剂(体积比5/1)中,在氩气保护下加入74mg催化剂醋酸钯、135mg有机膦配体2-双环己基膦-2',6'-二甲氧基联苯(Sphos)和6.98g磷酸钾,反应体系在氩气氛围下回流反应15小时。反应结束后,将反应体系降温至室温,加入30mL水,混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用甲苯重结晶,得到3.5g式(XIV)的化合物,收率为80%。
通过采用核磁共振、质谱分析和元素分析法对得到的式(XIV)的化合物进行结构表征,结果如下:
1H NMR(400MHz,CDCl3)δ:8.65(s,2H),8.09(d,J=7.6Hz,4H),8.03(s,2H),7.79(d,J=8.4Hz,4H),7.51–7.43(m,8H),3.70–3.65(m,4H),0.38(t,J=7.1Hz,6H)。
由于产物在各种溶剂中基本不溶解,最终没有得到碳谱。
高分辨质谱分析结果:662.15855。
元素分析结果:C,76.12%;H,4.57%。
式(XVI)的化合物的合成:
在经火焰干燥的三颈圆底烧瓶中,加入8.0g式(XIV)的化合物和20mL四氢呋喃中,在氩气保护下加入14.49mL对己基苯溴化镁(2M的四氢呋喃溶液),反应体系升温至90℃反应6h。反应结束后,将反应体系降温至0℃,加入20mL水,混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,直接用于下步反应。
在干燥的三颈圆底烧瓶中,以上得到的粗产物溶解在30mL甲苯中,加入1.00g固体酸催化剂Amberlyst 15,氩气保护下升温至回流反应6h。反应结束后,将反应体系降温至室温,加入30mL水,混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用甲苯/石油醚(沸程为60-90℃)重结晶,得到4.57g式(XIV)的化合物,收率78%。
采用核磁共振、质谱分析和元素分析法对式(XIV)的化合物进行结构表征,结果如下:
1H NMR(500MHz,THF)δ:8.96(d,J=8.8Hz,2H),8.39(s,2H),8.00(d,J=8.5Hz,2H),7.92(d,J=8.2Hz,2H),7.55–7.52(m,2H),7.46–7.42(m,2H),7.43–7.40(m,2H),7.10(d,J=6.5Hz,2H),7.04–6.98(m,18H),2.54(t,J=7.7Hz,8H),1.60–1.54(m,8H),1.35–1.26(m,24H),0.86–0.83(m,12H)。
13C NMR(125MHz,THF-d8)δ:148.20,145.77,142.91,141.66,136.32,133.49,133.09,132.14,130.43,129.99,129.86,128.29,128.10,128.04,127.27,127.21,127.00,126.77,126.08,125.89,125.61,124.53,67.73,59.03,36.08,32.46,32.15,29.86,25.61,23.27,14.20。
高分辨质谱分析结果:1182.61382。
元素分析结果:C,87.27%;H,7.33%。
式(XVIIII)的化合物的合成:
在圆底烧瓶中加入10.0g式(XVI)的化合物和50mL氯仿,缓慢加入225mg N-溴代丁二酰亚胺。反应体系在-10℃下避光搅拌10min。加入30mL水,用氯仿(3×15mL)萃取三次,合并有机相,然后用大量的水洗,然后用无水硫酸钠干燥后过滤。浓缩滤液后得到的粗产物直接用于下一步反应。
干燥的Schlenk反应瓶中,将以上得到的粗产物、0.94g式(XVI)的化合物和729mg NaOtBu溶解在20mL甲苯中,在氮气氛围的手套箱中加入93mg催化剂Pd2(dba)3和0.38mL有机膦配体P(t-Bu)3(质量分数为10%的甲苯溶液),反应体系在氩气氛围下回流反应8小时。反应结束后,将反应体系降温至室温,加入30mL水,混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用甲苯/石油醚(沸程为60-90℃)(体积比1/5)作为展开剂柱层析,2.3g式(XVIII)的化合物,收率58%。
采用核磁共振、质谱分析和元素分析法对式(XVIII)的化合物进行结构表征,结果如下:
1H NMR(500MHz,THF-d8)δ:9.02(d,J=8.9Hz,2H),8.96(d,J=9.0Hz,2H),8.40(s,1H),8.18(d,J=8.8Hz,1H),8.14(d,J=8.0Hz,1H),8.00(d,J=8.5Hz,1H),7.93(d,J=8.1Hz,1H),7.55–7.48(m,2H),7.46–7.40(m,2H),7.38–7.31(m,2H),7.11(d,J=6.5Hz,1H),7.08–7.03(m,11H),7.00–6.98(m,8H),6.94–6.91(m,4H),6.69–6.66(m,4H),3.84(t,J=6.5Hz,4H),2.57–2.53(m,8H),1.70–1.67(m,3H),1.61–1.54(m,8H),1.47–1.41(m,4H),1.34–1.32(m,15H),1.30–1.28(m,18H),0.91–0.88(m,6H),0.86–0.83(m,12H)。
13C NMR(125MHz,THF-d8)δ:154.62,148.49,148.24,145.78,145.71,143.50,142.88,142.70,141.76,141.69,138.92,136.67,136.25,133.60,133.41,133.10,132.15,131.99,131.42,130.44,130.00,129.89,128.56,128.35,128.31,128.13,127.93,127.31,127.22,127.14,127.11,126.88,126.78,126.29,126.21,125.92,125.64,124.63,124.53,124.50,121.85,115.65,68.45,67.74,59.06,59.03,36.10,32.48,32.39,32.18,30.15,29.89,26.55,25.62,23.33,23.29,14.22,14.20。
高分辨质谱分析结果:1549.86356。
元素分析结果:C,85.18%;H,7.74%;N,0.91%。
式(I-1)的化合物的合成:
在圆底烧瓶中加入1.0g式(XVIII)的化合物和15mL四氢呋喃,缓慢加入114mg N-溴代丁二酰亚胺。反应体系在室温下避光搅拌8h。加入30mL水,用氯仿(3×15mL)萃取三次,合并有机相,用无水硫酸钠干燥后过滤。浓缩滤液后得到的粗产物用甲苯(沸程为60-90℃)/石油醚(体积比1/3)作为洗脱剂通过硅胶柱层析分离,得到的粗产物直接用于下一步反应。
在干燥的Schlenk反应瓶中,将以上得到的粗产物、388mg三键苯甲酸丁酯和230mg Cs2CO3溶解在25mL 1,4-二氧六环中,在氮气氛围的手套箱中加入53mg催化剂Pd2(dba)3和0.19mL有机膦配体P(t-Bu)3(质量分数为10%的甲苯溶液),反应体系在氩气氛围下回流反应8小时。反应结束后,将反应体系降温至室温,加入30mL水,混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用甲苯(沸程为60-90℃)/石油醚(体积比1/1)作为展开剂柱层析,得到紫色粉末丁酯化合物。
在三颈圆底烧瓶中,将以上得到的丁酯化合物溶解在15mL四氢呋喃和5mL水中,向反应体系中加入358mg氢氧化钾,升温至80℃搅拌反应6h。反应结束后,将反应体系降温至室温,加入20mL磷酸水溶液(0.1mol/L),混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用三氯甲烷/甲醇(体积比20/1)作为展开剂柱层析,得到944mg式(I-1)的化合物,收率87%。
通过采用核磁共振、质谱分析和元素分析法对得到的式(II-1)的化合物进行结构表征,结果如下:
1H NMR(400MHz,THF-d8)δ:9.03-9.00(m,2H),8.75-8.73(m,1H),8.67(d,J=8.5Hz,1H),8.19-8.11(m,4H),7.87(d,J=8.3Hz,2H),7.66-7.57(m,3H),7.51(t,J=7.0Hz,1H),7.39-7.31(m,2H),7.16(d,J=6.7Hz,1H),7.08-7.04(m,11H),6.99-6.97(m,8H),6.93-6.91(m,4H),6.69-6.67(m,4H),3.84(t,J=6.4Hz,4H),2.55(t,J=7.6Hz,8H),2.08-2.00(m,2H),1.62-1.54(m,8H),1.47-1.40(m,6H),1.34-1.29(m,32H),0.91-0.83(m,18H)。
13C NMR(100MHz,THF-d8)δ:154.65,149.96,148.56,145.68,145.41,143.48,143.44,142.71,141.91,141.81,139.11,137.79,136.33,133.92,133.86,133.18,133.03,131.99,131.96,131.42,130.50,130.43,130.34,130.32,130.26,130.05,128.62,128.41,128.37,128.16,127.98,127.60,127.57,127.52,127.25,127.18,126.90,126.87,126.74,126.72,126.49,126.41,126.30,126.26,124.52,121.87,117.33,115.68,102.12,90.19,68.49,59.22,59.06,36.09,35.99,32.67,32.47,32.38,32.14,30.53,30.51,30.43,30.41,30.36,30.34,30.28,30.15,30.10,30.08,30.06,30.04,29.87,27.82,26.54,26.22,25.65,25.45,25.22,25.02,23.36,23.32,23.27,14.23,14.20,14.17。
高分辨质谱分析结果:1693.88467。
元素分析结果:C,84.29%;H,7.30%;N,0.82%。
实施例2
式(I-2)结构化合物的制备
反应历程2
式(I-1)的化合物的合成:
在圆底烧瓶中加入1.0g式(XVIII)的化合物和15mL四氢呋喃,缓慢加入114mg N-溴代丁二酰亚胺。反应体系在室温下避光搅拌8h。加入30mL水,用氯仿(3×15mL)萃取三次,合并有机相,用无水硫酸钠干燥后过滤。浓缩滤液后得到的粗产物用甲苯(沸程为60-90℃)/石油醚(体积比1/3)作为洗脱剂通过硅胶柱层析分离,得到的粗产物直接用于下一步反应。
在干燥的Schlenk反应瓶中,将以上得到的粗产物、646mg三键苯并噻二唑苯甲酸丁酯和230mg Cs2CO3溶解在25mL 1,4-二氧六环中,在氮气氛围的手套箱中加入53mg催化剂Pd2(dba)3和0.19mL有机膦配体P(t-Bu)3(质量分数为10%的甲苯溶液),反应体系在氩气氛围下回流反应10小时。反应结束后,将反应体系降温至室温,加入30mL水,混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用甲苯(沸程为60-90℃)/石油醚(体积比2/1)作为展开剂柱层析,得到紫色粉末丁酯化合物。
在三颈圆底烧瓶中,将以上得到的丁酯化合物溶解在24mL四氢呋喃和8mL水中,向反应体系中加入358mg氢氧化钾,升温至80℃搅拌反应8小时。反应结束后,将反应体系降温至室温,加入20mL磷酸水溶液(0.1mol/L),混合液用氯仿萃取三次,合并有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,浓缩滤液,用三氯甲烷/甲醇(体积比20/1)作为展开剂柱层析,得到995mg式(I-2)的化合物,收率85%。
通过采用核磁共振、质谱分析和元素分析法对得到的式(II-2)的化合物进行结构表征,结果如下:
1H NMR(400MHz,THF-d8)δ:9.06–8.99(m,4H),8.23–8.13(m,7H),7.99(d,J=7.4Hz,1H),7.70–7.60(m,3H),7.51(t,J=7.1Hz,1H),7.39–7.31(m,2H),7.20(d,J=6.8Hz,1H),7.10–7.05(m,12H),7.02–6.98(m,7H),6.93(d,J=8.9Hz,4H),6.68(d,J=8.9Hz,4H),3.83(t,J=6.2Hz,4H),2.56(t,J=7.4Hz,8H),2.09–2.03(m,2H),1.60–1.55(m,8H),1.45–1.40(m,6H),1.34–1.30(m,32H),0.89–0.84(m,18H)。
13C NMR(100MHz,THF-d8)δ:167.21,156.41,154.65,153.83,150.12,148.58,145.68,145.43,143.45,143.44,142.72,141.93,141.81,141.72,139.12,137.90,136.35,134.12,133.90,133.88,133.26,133.23,132.72,132.00,131.59,131.43,130.46,130.43,130.34,130.32,130.06,129.85,129.05,128.63,128.59,128.43,128.38,127.99,127.66,127.55,127.29,127.19,126.94,126.75,126.66,126.48,126.31,126.27,124.53,121.88,117.72,117.57,115.68,99.41,95.24,68.48,67.78,67.56,67.35,59.26,59.07,36.10,35.99,32.67,32.47,32.38,32.15,30.53,30.52,30.44,30.36,30.34,30.28,30.15,30.09,30.06,30.04,29.88,27.82,26.54,26.22,25.65,25.46,25.26,25.02,23.35,23.32,23.28,14.21,14.18。
高分辨质谱分析结果:1827.88001。
元素分析结果:C,82.07%;H,6.90%;N,2.31%。
实施例3:
根据文献(Energy Environ.Sci.,2010,3,1924)制备有机染料敏化太阳电池,具体过程如下:
分别将实施例1~2制备的有机染料(即式(I-1)所示结构的化合物和式(I-2)所示结构的化合物)制备成150μmol/L的乙醇/氯仿(体积比8:2)溶液。
将TiO2结构双层膜电极在上述各个溶液中分别浸泡12小时以在该TiO2膜上吸附有机染料分子作为光敏化剂,取出电极,将覆盖纳米铂的玻璃电极用热熔环密封,最后将电解质注入到两个电极的缝隙中,即构成了染料敏化太阳电池。
本发明实施例3提供的染料敏化太阳能电池的制备工艺和结构示意图见图1~图3,图1为本发明提供的染料敏化太阳能电池的结构示意图;图2为本发明提供的染料敏化太阳能电池中的光吸收层的结构示意图;图3为本发明提供的染料敏化太阳电池的制作工艺流程图。
在100mW cm-2,模拟AM1.5G太阳光下,对制备的染料敏化太阳电池进行性能检测,测试结果见表1,表1为本发明实施例提供的有机染料制备的染料敏化太阳电池的性能测试结果。
表1
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
一种蒽基稠环芳烃有机染料及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0