专利摘要
本发明属于近红外染料的制备技术领域,涉及一种并噻吩并吡咯醌式化合物的制备方法。该类染料在空气中的稳定性好,在近红外区域具有强烈的吸光能力,最大吸收波长在709~880nm,同时具有较低的LUMO能级、较窄的HOMO‑LUMO能级带隙,共轭体系范围大且具有很好的平面性、自组装能力强、溶解性好、有利于溶液加工。这类染料在生物成像、光学记录、有机太阳能电池及有机场效应晶体管等领域都有着极大的应用价值。
权利要求
1.一类如通式I所示的并噻吩并吡咯醌式化合物:
其中,R为H、C1~C30的正烷基或C3~C40的支链烷基;
为醌式结构。
2.根据权利要求1所述的并噻吩并吡咯醌式化合物,其特征在于,所述的醌式结构选自苯醌结构、噻吩并噻吩醌式结构或苯并二噻吩醌式结构。
3.根据权利要求1或2所述的并噻吩并吡咯醌式化合物,其特征在于,所述的C1~C30的正烷基为C2~C10的正烷基,所述的C3~C40的支链烷基为C15~C30的支链烷基。
4.根据权利要求3所述的并噻吩并吡咯醌式化合物,其特征在于,所述的C2~C10的正烷基为正丙基;所述的C15~C30的支链烷基为2-癸基十四烷基。
5.根据要求2所述的并噻吩并吡咯醌式化合物,其特征在于,
制备苯醌结构的中间体化合物为式IVa、式IIa和式IIIa所示:
制备噻吩并噻吩醌式结构的中间体化合物为式IVb、式IIb和式IIIb所示:
制备苯并二噻吩醌式结构的中间体化合物为式VIc、式Vc、式IVc、式IIc和式IIIc所示:
6.根据权利要求1~5任一项所述的式I化合物的制备方法,其特征在于包含下述步骤:
(1)将化合物II与丙二腈负离子进行偶联反应,制得化合物III;
(2)将化合物III进行氧化反应,即得:
R为H、C1~C30的正烷基或C3~C40的支链烷基;Y为卤素。
7.根据权利要求6所述的制备方法,其特征在于,步骤(1)中所述的偶联反应包含下列步骤:有机溶剂中,将化合物II在磷配体配位的零价钯试剂的催化下与丙二腈负离子进行反应,即可;其中,所述的有机溶剂为烷氧醚类溶剂;所述的磷配体配位的零价钯试剂为四(三苯基膦)钯;所述的磷配体配位的零价钯试剂与化合物II的摩尔比为0.01:1~0.5:1;所述的丙二腈负离子与化合物II的摩尔比为2:1~10:1;所述的反应的温度为80~100℃;所述的反应时间以检测反应完成为止。
8.根据权利要求7所述的制备方法,其特征在于,步骤(1)中的丙二腈负离子由丙二腈和强碱在有机溶剂中反应制得;其中,所述的有机溶剂为烷氧醚类溶剂;所述的强碱为活泼金属氢化物;所述的强碱与丙二腈的摩尔比为2:1~5:1;所述的反应温度为-10℃~10℃;所述的反应时间为30min~1h。
说明书
技术领域
本发明属于近红外染料的制备技术领域,涉及一种并噻吩并吡咯醌式化合物的制备方法。
背景技术
近红外染料是指可在700~2000nm区域进行光学吸收或荧光发射的一类染料。这类染料在生物成像、光学记录、有机太阳能电池及有机场效应晶体管等领域都有着极大的应用价值。开发新型结构近红外染料具有重要的实际意义。
醌式结构化合物的分子骨架平面性好、刚性强。该类化合物的LUMO能级通常低于-4eV,因而对氧气和水都不敏感,稳定性非常好。同时其能级带隙窄、摩尔吸光系数大,是一类很有应用价值的有机材料。特别地,近十几年来,四氰基噻吩型醌式化合物作为n-型及双极型有机半导体材料在有机场效应晶体管领域被广泛研究。
从骨架结构上分类,噻吩型醌式化合物可分为寡噻吩型和并噻吩型两类。寡噻吩型醌式化合物具有合成简单、分子扩展方便等特点。例如,Takahashi等人开发了一系列以二氰基亚甲基为端基、1~6个噻吩单元组成的寡噻吩链为骨架的四氰基醌染料,该类染料的吸收光谱的最大吸收波长随噻吩链长度的增加而从412nm大幅红移至近红外区的1012nm,摩尔吸光系数达105M-1cm-1以上(参见:Takahashi T.,Matsuoka K.,Takimiya K.,et al.J.Am.Chem.Soc.2005,127,8928–8929)。
虽然寡噻吩型醌式化合物有着非常优异的光学性质,但其结构上却存在着容易产生顺反异构体的问题(参见:Handa S,Miyazaki E,Takimiya K,et al.J.Am.Chem.Soc.2007,129(38):11684–11685;Handa S,Miyazaki E,Takimiya K.Chem.Comm.2009(26):3919)。解决该问题最好的方法是使用并环噻吩等作为分子骨架。朱道本等人报道了分别以并四噻吩和噻吩型并五环为分子骨架的四氰基醌染料,其在溶液中的最大吸收波长分别为635nm和670nm左右(参见:Wu Q,Li R,Hong W,et al.Chem.Mater.2011,23(13):3138–3140;Li J,Qiao X,Xiong Y,et al.Chem.Mater.2014,26(19):5782–5788)。以更大并环体系为分子骨架的四氰基醌式化合物尚未有报道。通过扩展分子骨架体系将会有效红移醌式化合物的吸收光谱,从而达到近红外吸收的目的。
发明内容
本发明的目的在于提供一类并噻吩并吡咯醌式结构近红外染料及其制备方法。
本发明涉及一类如式I所示的并噻吩并吡咯醌式化合物。
其中,R为H、C1~C30的正烷基或C3~C40的支链烷基;
为醌式结构
其中,所述的C1~C30的正烷基为C2~C10的正烷基,所述的C3~C40的支链烷基为C15~C30的支链烷基;
其中,所述的C2~C10的正烷基为正丙基;所述的C15~C30的支链烷基为2-癸基十四烷基;
在本发明的一个实施方案中,本发明化合物是:
本发明的另一个目的还涉及制备上述本发明化合物的方法,其包括下述步骤:
(1)将化合物II与丙二腈负离子进行偶联反应,制得化合物III;
(2)将化合物III进行氧化反应,即得:
其中R基团的定义同前所述;X为卤素,优选碘。
其中,步骤(1)中,所述的偶联反应的方法和条件均可为本领域此类反应的常规方法和条件。本发明特别优选下述方法和条件:有机溶剂中,将化合物II在磷配体配位的零价钯试剂的催化下,与丙二腈负离子进行偶联反应,即可。
其中,有机溶剂为本领域此类反应的常规溶剂,优选乙二醇二甲醚。所述的磷配体配位的零价钯试剂优选四(三苯基膦)钯(0)。所述的磷配体配位的零价钯试剂与化合物II的摩尔比为0.01:1~0.5:1,优选0.1:1;所述的丙二腈负离子与化合物II的摩尔比为2:1~10:1,优选5:1;所述的反应的温度为80~100℃;所述的反应时间以检测反应完成为止。
其中,步骤(1)中的丙二腈负离子由丙二腈和强碱在有机溶剂中反应制得;其中,所述的有机溶剂为烷氧醚类溶剂,优选乙二醇二甲醚;所述的强碱为活泼金属氢化物,优选氢化钠;所述的强碱与丙二腈的摩尔比为2:1~5:1,优选2:1;所述的反应温度为-10℃~10℃,优选0℃;所述的反应时间为30min~1h。
其中,步骤(2)中所述的氧化反应包含下列步骤:将化合物III直接暴露于空气中与氧气反应,即可。
本发明还涉及如式IVa、IIa、IIIa所示的制备式Ia化合物的中间体化合物;
本发明还涉及如式IVb、IIb、IIIb所示的制备式Ib化合物的中间体化合物;
本发明还涉及如式VIc、Vc、IVc、IIc、IIIc所示的制备式Ic化合物的中间体化合物;
本发明中所述的原料和试剂除特别说明外,均市售可得。
本发明的积极进步效果在于:本发明提供的并噻吩并吡咯醌式结构近红外染料在空气中的稳定性好,在近红外区域具有强烈的吸光能力,最大吸收波长在709~880nm,同时具有较低的LUMO能级、较窄的HOMO-LUMO能级带隙、共轭体系范围大且具有很好的平面性、自组装能力强、溶解性好、有利于溶液加工。该类染料同时可作为有机功能材料应用于有机场效应晶体管等领域。
附图说明
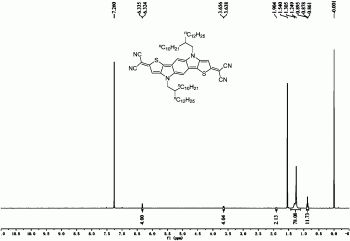
图1为化合物Ia的1H-NMR谱图。
图2为化合物VIa的1H-NMR谱图。
图3为化合物VIa的13C-NMR谱图。
图4为化合物Ib的1H-NMR谱图。
图5为化合物VIb的1H-NMR谱图。
图6为化合物VIb的13C-NMR谱图。
图7为化合物Ic的1H-NMR谱图。
图8为化合物IVc的1H-NMR谱图。
图9为化合物IVc的13C-NMR谱图。
图10为化合物Vc的1H-NMR谱图。
图11为化合物Vc的13C-NMR谱图。
图12为化合物VIc的1H-NMR谱图。
图13为化合物VIc的13C-NMR谱图。
图14为化合物X的1H-NMR谱图。
图15为化合物X的13C-NMR谱图。
图16为化合物Ia、化合物Ib和化合物Ic的紫外-可见吸收光谱。
具体实施方式
下面用实施例来进一步说明本发明,但本发明并不受其限制。
实施例中所用的原料和试剂除特别说明外,均市售可得。
实施例中所述的室温均指15~35℃。
实施例1化合物Ia的制备
在-78℃、氮气保护下,向装有化合物IVa(113.0mg,0.12mmol)和四氢呋喃(2mL)的10mL三口烧瓶中缓慢滴加正丁基锂(1.6M in hexane,188μL,0.30mmol),保持-78℃反应30分钟,加入单质碘(76.1mg,0.30mmol),升至室温反应2小时后,加入饱和硫代硫酸钠溶液(5mL)进行淬灭,用乙醚萃取(30mL×3),合并有机相并用饱和食盐水洗涤,以无水硫酸镁干燥,旋转蒸发除去溶剂,得到粗产品化合物IIa,并将其直接用于下一步反应。
在0℃、氮气保护下,向装有氢化钠(48.0mg,60wt%,1.2mmol)和1,2-二甲氧基乙烷(5mL)的20mL三口烧瓶中一次性加入丙二腈(39.6mg,0.60mmol),泡沫消除后升至室温反应30分钟。将所制得的丙二腈阴离子溶液通过插管转移到装有化合物IIa、四(三苯基膦)钯(13.9mg,0.012mmol)和1,2-二甲氧基乙烷(10mL)的50mL三口烧瓶中,在氮气保护下加热回流反应3小时。随后将反应降至室温,并暴露于空气中,加入稀盐酸(10mL,1M),在冰水浴中搅拌30分钟,用乙醚萃取(30mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去溶剂,残留物经硅胶柱色谱分离(洗脱剂:正己烷/二氯甲烷=1/4)后得到化合物Ia(蓝色固体,90.0mg,收率:70%)。1H NMR(400MHz,CDCl3)δ6.34(s,2H),6.32(s,2H),3.65(d,J=7.2Hz,4H),1.90(m,2H),1.31–1.25(m,80H),0.90–0.86(m,12H);HRMS(EI,m/z)calcd for C68H102N6S2:1066.7607[M]+;found:1066.7662.
实施例2化合物IVa的制备
向50mL三口烧瓶中加入化合物IIV(279.0mg,0.5mmol)、叔丁醇钠(768.8mg,8.0mmol)、三(二亚苄基丙酮)二钯(457.9mg,0.5mmol)、2,2'-双-(二苯膦基)-1,1'-联萘(BINAP,1.25g,2.0mmol)和甲苯(10mL),在25℃下搅拌20分钟后加入化合物IIIV(707.4mg,2.0mmol),加热至120℃反应24小时。冷却至室温后,加入水(20mL),用乙醚萃取(30mL×3),合并有机相并用饱和食盐水洗涤,以无水硫酸镁干燥,旋转蒸发除去溶剂,残留物经硅胶柱色谱分离(洗脱剂:石油醚)后得到化合物IVa(白色固体,277.0mg,收率:80%)。1H NMR(400MHz,CDCl3)δ7.59(s,2H),7.34(d,J=5.2Hz,2H),7.05(d,J=5.2Hz,2H),4.16(d,J=7.2Hz,4H),2.17(m,2H),1.38–1.23(m,80H),0.88(m,12H);13C NMR(100MHz,CDCl3)δ146.8,138.2,125.7,119.4,115.0,110.8,98.3,50.1,38.3,32.00,31.99,31.8,30.1,29.73,29.69,29.44,29.40,26.6,22.8,14.2;HRMS(EI,m/z)calcd for C62H104N2S2:940.7641[M]+;found:940.7625.
实施例3化合物Ib的制备
在-78℃、氮气保护下,向装有化合物IVb(120.5mg,0.12mmol)和四氢呋喃(2mL)的10mL三口烧瓶中一次性加入N-溴代丁二酰亚胺(NBS,64.1mg,0.36mmol),保持-78℃反应1小时后,用乙醚萃取(10mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去有机溶剂,得到粗产品化合物IIb,并将其直接用于下一步反应。
在0℃、氮气保护下,向装有氢化钠(48.0mg,60wt%,1.2mmol)和1,2-二甲氧基乙烷(5mL)的20mL三口烧瓶中一次性加入丙二腈(39.6mg,0.6mmol),泡沫消除后升至室温反应30分钟。将所制得的丙二腈阴离子溶液通过插管转移到装有化合物IIb、四(三苯基膦)钯(13.9mg,0.012mmol)和1,2-二甲氧基乙烷(5mL)的50mL三口烧瓶中,在氮气保护下加热回流反应3小时。随后将反应降至室温,并暴露于空气中,加入稀盐酸(10mL,1M),在冰水浴中搅拌30分钟,用乙醚萃取(30mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去有机溶剂,残留物经硅胶柱色谱分离(洗脱剂:正己烷/二氯甲烷=1/4)后得到化合物Ib(蓝色固体,90.0mg,收率:66%)。1H NMR(400MHz,CDCl3)δ6.40(s,2H),3.78(d,J=7.6Hz,4H),1.94(m,2H),1.25(m,80H),0.9–0.86(m,12H);HRMS(ESI,m/z)calcd forC68H101N6S4:[M+H]+,1129.6971;found:1129.6971.
实施例4化合物IVb的制备。
向50mL三口烧瓶中分别加入化合物IX(310.0mg,0.5mmol)、叔丁醇钠(768.8mg,8.0mmol)、二(二亚苄基丙酮)钯(28.8mg,0.05mmol)、1,1'-双(二苯基膦)二茂铁(110.9mg,0.2mmol)和甲苯(10mL),在25℃下搅拌20分钟后加入2-癸基十四烷基胺(410.3mg,1.16mmol),加热至110℃反应10小时。待冷却至室温后,加入水(20mL)进行淬灭,用乙醚萃取(30mL×3),合并有机相并用饱和食盐水洗涤,以无水硫酸镁干燥,旋转蒸发除去有机溶剂,经硅胶柱色谱分离(洗脱剂:石油醚)后得到化合物IVb(淡黄色粘稠状固体,282.0mg,收率:56%)。1H NMR(400MHz,Benzene-d6)δ7.10(d,J=5.2Hz,2H),6.99(d,J=5.2Hz,2H),4.16(d,J=7.6Hz,4H),2.13(m,2H),1.25–1.21(m,80H),0.88–0.85(m,12H);13C NMR(100MHz,Benzene-d6)δ144.5,137.7,122.3,122.1,116.3,114.6,111.1,52.4,39.6,32.13,32.12,31.9,30.1,30.0,29.91,29.87,29.86,29.7,29.62,29.59,26.6,22.9,14.2;HRMS(EI,m/z)calcd forC62H102N2S4:1002.6926[M]+;found:1002.6986.
实施例5化合物Ic的制备
向装有化合物IVc(117.0mg,0.1mmol)、四氢呋喃(1mL)和N,N-二甲基甲酰胺(DMF,1mL)的10mL三口烧瓶中分批加入N-溴代丁二酰亚胺(NBS,44.5mg,0.25mmol),在-78℃、氮气保护下反应3小时,加入冰水淬灭,用乙醚萃取(30mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去溶剂,得到粗产品化合物IIc,并将其直接用于下一步反应。
在0℃、氮气保护下,向装有氢化钠(40.0mg,60wt%,1.0mmol)和1,2-二甲氧基乙烷(1mL)的20mL三口烧瓶中一次性加入丙二腈(33.0mg,0.5mmol),泡沫消除后升至室温反应30分钟。将所制得的丙二腈阴离子溶液通过插管转移到装有化合物IIc、四(三苯基膦)钯(23.1mg,0.02mmol)和1,2-二甲氧基乙烷(1mL)的20mL三口烧瓶中,在氮气保护下加热回流反应3小时。随后将反应降至室温,并暴露于空气中,加入稀盐酸(10mL,1M),在冰水浴中搅拌30分钟,用乙醚萃取(30mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去溶剂,经硅胶柱色谱分离(洗脱剂:正己烷/二氯甲烷=1/1)后得到化合物Ic(绿色固体,104.0mg,收率:80%)。1H NMR(400MHz,CDCl3)δ6.65(bs,2H),4.33(t,J=7.2Hz,4H),3.98(d,J=7.2Hz,4H),1.96(m,2H),1.80–1.71(m,4H),1.53(m,4H),1.28–1.23(m,76H),0.88(m,18H);HRMS(ESI,m/z)calcd for C78H115N6O2S4:1295.7964[M+H]+;found:1295.7872.实施例6化合物IVc的制备
向10mL三口烧瓶中加入化合物Vc(137.5mg,0.1mmol)、叔丁醇钠(153.8mg,1.6mmol)、二(二亚苄基丙酮)钯(5.8mg,0.01mmol)、1,1'-双(二苯基膦)二茂铁(22.2mg,0.04mmol)和甲苯(1mL),在25℃下搅拌20分钟后加入正丙胺(17.7mg,0.3mmol),加热至110℃反应10小时。待冷却至室温后,加入饱和食盐水,用乙醚萃取(30mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去溶剂,残留物经硅胶柱色谱分离(洗脱剂:石油醚)后得到化合物IVc(黄色固体,70.8mg,收率:60%)。1H NMR(400MHz,Benzene-d6)δ6.82(d,J=5.2Hz,2H),6.75(d,J=5.2Hz,2H),4.69(t,J=7.2Hz,4H),4.14(d,J=6.8Hz,4H),2.30(m,2H),1.78(m,4H),1.60–1.31(m,80H),0.92(m,12H),0.67(t,J=7.2Hz,6H);13C NMR(100MHz,Benzene-d6)δ147.3,143.6,136.7,134.4,124.3,120.0,116.4,115.4,111.7,78.3,50.1,39.4,34.0,32.1,31.7,31.4,30.4,30.0,29.9,29.6,27.4,27.2,27.1,24.2,22.9,14.1,11.1;HRMS(EI,m/z)calcd for C72H116N2O2S4:1168.7920[M]+;found:1168.7946.
实施例7化合物Vc的制备
在-78℃、氮气保护下,向装有2,3-二溴噻吩(290.3mg,1.2mmol)的乙醚(1.5mL)溶液的20mL三口烧瓶中缓慢滴加正丁基锂(1.6M in hexane,0.825mL,1.32mmol),保持-78℃反应1小时,加入氯化锌的四氢呋喃溶液(2.52mL,0.5M,1.26mmol),升温至0℃反应1小时,加入化合物VIc(484.5mg,0.4mmol)和四(三苯基膦)钯(139.0mg,0.12mmol),加热至50℃反应20小时。待冷却至室温,加入饱和氯化铵溶液,用乙醚萃取(30mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去有机溶剂,残留物经硅胶柱色谱分离(洗脱剂:石油醚)后得到化合物Vc(黄色油状液体,330.2mg,收率:60%)。1H NMR(400MHz,CDCl3)δ7.50(d,J=5.6Hz,2H),7.14(d,J=5.6Hz,2H),4.12(d,J=6.4,4H),2.10(m,2H),1.61(m,4H),1.50–1.25(m,80H),0.88(m,12H);13C NMR(100MHz,CDCl3)δ144.7,132.3,131.02,130.95,129.4,129.1,128.4,113.6,105.9,79.4,39.0,32.0,31.1,30.1,29.73,29.69,29.39,29.38,26.9,22.7,14.2;HRMS(ESI,m/z)calcd for C66H103Br4O2S4:1375.3533[M+H]+;found:1375.3521.
实施例8化合物VIc的制备
在0℃下,向装有化合物X(2.68g,3.0mmol)和氯仿(30mL)的100mL三口烧瓶中,缓慢滴加液溴(1.23mL,24.0mmol)的氯仿(30mL)溶液,室温反应10小时后,加饱和硫代硫酸钠溶液淬灭,用二氯甲烷萃取(30mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去溶剂,经硅胶柱色谱分离(洗脱剂:石油醚)后得到化合物VIc(白色固体,3.12g,收率:86%)。1H NMR(400MHz,CDCl3)δ3.99(d,J=6.4Hz,4H),2.06(m,2H),1.57(m,4H),1.46–1.26(m,80H),0.88(m,12H);13C NMR(100MHz,CDCl3)δ143.2,132.2,128.0,116.6,107.1,79.4,39.0,32.0,31.1,30.2,29.83,29.79,29.7,29.5,26.9,22.8,14.2;HRMS(ESI,m/z)calcd for C58H99Br4O2S2:1211.3779[M+H]+;found:1211.3763.
在氮气保护下,向20mL单口烧瓶中分别加入化合物XI(220.3mg,1.0mmol)、锌粉(163.5mg,2.5mmol)、氢氧化钠(600.0mg,15.0mmol)和水(3mL),加热回流1小时,随后加入2-癸基十四烷基溴(1.25g,3.0mmol)和四丁基溴化铵(TBAB,19.3mg,0.06mmol),继续回流6小时后,将反应液投入到冰水中,并用乙醚萃取(35mL×3),合并有机相并用无水硫酸镁干燥,旋转蒸发除去有机溶剂,残留物经硅胶柱色谱分离(洗脱剂:石油醚)后得到化合物X(无色油状液体,582.5mg,收率:65%)。1H NMR(400MHz,CDCl3)δ7.47(d,J=5.6Hz,2H),7.35(d,J=5.6Hz,2H),4.17(d,J=5.2Hz,4H),1.86(m,2H),1.64(m,4H),1.49–1.27(m,80H),0.88(m,12H);13C NMR(100MHz,CDCl3)δ144.7,131.6,130.0,125.8,120.3,76.3,39.3,32.1,31.4,30.2,29.8,29.5,27.1,22.8,14.2;HRMS(EI,m/z)calcd for C58H102O2S2:894.7321[M]+;found:894.7285.
效果实施例1化合物Ia、实施例3化合物Ib和实施例5化合物Ic的紫外-可见吸收光谱。
化合物Ia、化合物Ib和化合物Ic的最大吸收波长位置分别为709nm、778nm和880nm。光学能级带隙分别为1.46eV、1.31eV和1.16eV。
效果实施例2化合物Ia、实施例3化合物Ib和实施例5化合物Ic的电化学性质。
循环伏安法测试在计算机控制的BAS100B电化学分析仪上进行,采用传统的三电极测试体系,即玻碳电极为工作电极,铂电极为对电极,Ag/Ag+电极为参比电极。样品溶于新蒸的二氯甲烷(摩尔浓度为10-3M),Bu4NPF6(0.1M)作为支持电解质;扫描速度为50mV/s,以二茂铁为参比,真空条件下二茂铁的能级为-4.8eV。因二氯甲烷中测得二茂铁相对SCE参比电极的半波氧化电位为0.39V(Ia)、0.41V(Ib)和0.41V(Ic),材料的HOMO和LUMO能级根据以下能级公式计算:
HOMO=-[Eox-EFc/Fc++4.8]eV;
LUMO=-[Ered-EFc/Fc++4.8]eV
电化学测试显示化合物Ia、化合物Ib和化合物Ic的半波氧化电位分别为1.21V、0.96V和0.80V,由此计算出三个化合物的HOMO能级分别为-5.62eV、-5.35eV和-5.18eV。
电化学测试显示化合物Ia、化合物Ib和化合物Ic的半波还原电位分别为-0.20V、-0.26V和-0.17V,由此计算出三个化合物的LUMO能级分别为-4.21eV、-4.13eV和-4.22eV。
根据下述能级公式计算化合物的电化学能级带隙:
Bandgap=LUMO-HOMO
根据公式计算得出化合物Ia、化合物Ib和化合物Ic的电化学能级带隙分别为1.41eV、1.22eV和0.96eV。
一类并噻吩并吡咯醌式结构化合物及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0