专利摘要
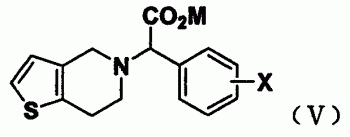
本发明提供了一种以氯吡格雷为代表的噻吩并四氢吡啶乙酸甲酯化合物的方法,包括如下步骤:式(V)化合物与甲基化试剂在碱性条件下,在水或有机溶剂或水与有机溶剂的混合溶液中于0-100℃反应,得所述产物;本发明提供的制备方法具有原料易得,反应简单、温和、操作简便,有害试剂及溶剂种类和用量少,工艺简单、环保,单程及多程收率高(每步收率都在80%以上)、中间体及中间过程可以分开进行,也可以不严格分离或者分开,进行“一锅”法反应等特点。
权利要求
1、一种如式(I)的噻吩并四氢吡啶乙酸甲酯化合物的制备方法,包括如下步骤:式(V)化合物与甲基化试剂在碱性条件下,在水或有机溶剂或水与有机溶剂的混合溶液中于0-100℃反应,得所述产物;
其中式(I)和(V)中X代表氢、氟、氯、溴或碘原子,M为碱金属原子。
2、如权利要求1所述的制备方法,其特征在于X代表2-氯,M为Na或K。
3、如权利要求1所述的制备方法,其特征在于所述的甲基化试剂为下列之一:硫酸二甲酯、一氯甲烷、一溴甲烷、磷酸三甲酯。
4、如权利要求1所述的制备方法,其特征在于所述的甲基化试剂与式(V)化合物的当量比为1-5∶1,所述水或有机溶剂或水与有机溶剂的混合溶液的量各按每1g式(V)化合物计算为1~5ml。
5、如权利要求1所述的制备方法,其特征在于所述的有机溶剂为下列之一或一种以上的任意组合:C1-C8醇、酯类溶剂、C3-C11的酮类溶剂、C1-C8的卤代烃溶剂、DMF、DEF、DMSO、THF、DME、二氧六环、乙腈。
6、如权利要求5所述的制备方法,其特征在于所述的有机溶剂为下列之一或一种以上的任意组合:甲醇、乙醇、C1-C8醇水任意比例的混合体系、乙酸乙酯、乙酸丁酯、丙酮、丁酮、甲基异丁基甲酮、甲苯、二甲苯、氯代苯、二氯甲烷、氯仿、二氯乙烷、DMF、DEF、DMSO、THF、DME、二氧六环、乙腈。
7、如权利要求6所述的制备方法,其特征在于所述的有机溶剂为下列之一或一种以上的任意组合:甲醇、正丁醇、甲苯。
8、如权利要求1所述的制备方法,其特征在于所述的碱性条件下采用下述之一的碱溶液或一种以上的任意组合:氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸氢钾、碳酸钾、三乙胺、吡啶,N,N-二烷基苯胺、醇钠,pH控制在8-12。
9、如权利要求1所述的制备方法,其特征在于所述的反应温度为30-80℃。
10、如权利要求1~9之一所述的制备方法,其特征在于所述反应在相转移催化剂作用下进行,催化剂用量为反应原料式(V)化合物质量的0.5-5%。
11、如权利要求10所述的制备方法,其特征在于所述的相转移催化剂为下列之一:三乙基苄基氯化铵、PEG400、PEG600、PEG800。
12、如权利要求11所述的制备方法,其特征在于所述的甲基化试剂与式(V)化合物的当量比为1-3∶1;所述的碱性条件下pH控制在8-10。
13、如权利要求1所述的制备方法,其特征在于所述的式(V)化合物由下述步骤制备而得:式(IV)化合物在碱溶液中、相转移催化剂作用下于60-130℃碱解得所述产物;所述的碱溶液为20-50%的碱水溶液与有机溶剂的混合液;
其中式(IV)中X代表氢、氟、氯、溴或碘原子。
14、如权利要求13所述的制备方法,其特征在于由式(IV)化合物制备式(V)化合物的反应中,所述的相转移催化剂为下列之一:三乙基苄基氯化铵、PEG400、PEG600、PEG800,催化剂用量为反应原料式(IV)质量的0.5-5%;所述的有机溶剂为C1-C8的醇或它们的任意组合,有机溶剂的用量按每1g式(IV)化合物计算为1~5ml。
15、如权利要求14所述的制备方法,其特征在于由式(IV)化合物制备式(V)化合物的反应中,所述的有机溶剂为下列之一或一种以上的任意组合:甲醇、乙醇、正丁醇。
16、如权利要求13所述的制备方法,其特征在于所述的碱解温度为90-120℃。
17、如权利要求13~16之一所述的制备方法,其特征在于所述碱的水溶液为35-50%的氢氧化钠或氢氧化钾水溶液或它们任意比例混合液,所述碱与式(IV)化合物的当量比为1-20∶1。
18、如权利要求1所述的制备方法,其特征在于所述的式(V)化合物由下述步骤制得:式(VII)化合物在20-50%的碱水溶液中、相转移催化剂作用下于1-11atm压力下、于80-200℃碱解得所述产物;
其中X代表氢、氟、氯、溴或碘原子,M为碱金属离子。
19、如权利要求18所述的制备方法,其特征在于由式(VII)化合物制备式(V)化合物反应中,所述的相转移催化剂为下列之一:三乙基苄基氯化铵、PEG400、PEG600、PEG800,催化剂用量为反应原料式(VII)化合物质量的0.1-10%。
20、如权利要求18所述的制备方法,其特征在于由式(VII)化合物制备式(V)化合物反应中,所述的碱解在水与有机溶剂的混合溶液中进行,所述的有机溶剂为C1-C8的醇或它们的任意组合,有机溶剂的用量按每1g式(VII)化合物计算为1~5ml。
21、如权利要求20所述的制备方法,其特征在于由式(VII)化合物制备式(V)化合物反应中,所述的有机溶剂为下列之一或一种以上的任意组合:甲醇、乙醇、正丁醇。
22、如权利要求18-21之一所述的制备方法,其特征在于所述碱水溶液为35-50%的氢氧化钠或氢氧化钾水溶液或者它们的混合溶液,碱与式(VII)化合物的当量比为1-20∶1;所述碱解反应的压力为1-11atm,反应温度为90-120℃。
23、如权利要求22所述的制备方法,其特征在于所述碱与式(VII)化合物的当量比为15-20∶1;所述碱解反应的压力为1-3atm。
24、如权利要求1所述的制备方法,其特征在于所述的式(V)化合物由式(VI)化合物加碱而得;
其中式(VI)中X代表氢、氟、氯、溴或碘原子。
说明书
技术领域(一)技术领域
本发明涉及一种以氯吡格雷为代表的噻吩并四氢吡啶乙酸甲酯化合物的制备方法,属于化学制药领域。
技术背景(二)背景技术
心脑血管血栓性疾病是一种常见的疾病,近年来以冠状血栓和脑血栓为主的血栓栓塞性疾病的发病率呈上升趋势,严重危害人类的健康,因此,对这类疾病的防治研究十分重要。血小板聚集是正常凝血机制中的一个关键环节,血小板的黏附、聚集、释放反应导致血栓形成。因此,抑制血小板聚集药物在治疗血栓病中发挥着重要作用,抗血小板凝聚药一直是人们研究的热点。
氯吡格雷是一种新型高效安全的抗血小板凝聚药物,结构为X=2-氯的式(I)化合物。它最先由法国SANOFI公司公开在FR2215948,FR2530247,FR 2612929等专利中,并于1986年研制开发成功,临床上应用于动脉粥状硬化疾病、急性冠状动脉综合症以及血栓性并发症等。1998年3月首先在美国上市,随后进入欧洲、加拿大、澳大利亚以及新加坡等多国市场,国内外需求量逐年上升。
(V) (VI) (III)
据报道,目前制备式(I)化合物的方法通常使用α-卤代苯基乙酸的衍生物为起始原料同噻吩乙胺的衍生物(US 4529596,GB 0420706,GB0466569,US 5204469,EP 465358,EP99802,EP 420706)进行反应和衍生得到。在所有方法中,式(IV)化合物及类似腈化合物(WO9851689,WO9851681)都不能直接水解得到式(V)化合物或者式(VI)化合物,它们都间接水解得到式(VII)化合物等然后再进一步水解得到式(I)化合物(WO02059128,CN1487943A)。
最近,印度卡地拉健康护理有限公司报道了一种式(IV)化合物的制备方法(WO02059128,CN1487943A),式(IV)化合物在合适的条件下能有效制备式(VII)化合物,近而衍生制备式(V)化合物、式(VI)化合物及式(I)化合物,该专利提到了由式(IV)化合物直接制备式(V)化合物、式(VI)化合物的方法,在制备事例中,没有提供碱性水解事例,事实上我们按其提供的方法和条件,只能制备式(VII)化合物,或者式(V)化合物及式(VI)化合物的收率太低而没有分离和生产的价值,其提供的酸性水解方法和条件也因为收率太低(报道38%)而没有竞争力。
目标化合物及其相关中间体的制备还可以参考以下文献和专利策略及方法:中国医药工业杂志,2002,33(4)206;WO9851681、WO9851682、WO9851689、WO9918110、US4876362、US5036156、US5132435、US5139170、US5204469和US6080875等。
发明内容(三)发明内容
本发明提供了一种操作方便、工艺简单、收率高的制备如式(I)的噻吩并四氢吡啶乙酸甲酯化合物的方法。
本发明还提供了所述噻吩并四氢吡啶乙酸甲酯化合物的中间体的制备方法。
本发明的技术方案、合成路线及构思示意如下方案一所示(以下反应路线仅为示意图,只代表反应特例和部分,不能被解释或理解为对本发明范围的限制):
方案一:消旋氯吡格雷类似物及系列中间体合成路线示意图
M=K,Na,Ca,Mg etc ROHC1-C8等脂肪(烷)醇
MeXn包括Me2SO4·MeCl,MeBr,Me3PO4等甲基化试 X=Br,Cl;F,I,etc
PTC(相转移催化剂)包括季铵(膦)盐,PEG 200-3000,冠醚等Y=Br,Cl;OTs,OMs,OAc otc
本发明所述的噻吩并四氢吡啶乙酸甲酯化合物的制备方法包括如下步骤:式(V)化合物与甲基化试剂在碱性条件下,在水或有机溶剂或水与有机溶剂的混合溶液中于0-100℃反应,得所述产物;
其中式(I)和式(V)中X代表氢、氟、氯、溴或碘原子,优选为2-氯;M为碱金属原子,优选为Na或K。
所述的甲基化试剂如:硫酸二甲酯、一氯甲烷、一溴甲烷、磷酸三甲酯等。甲基化试剂与式(V)化合物的当量比优选为1-5∶1,再优选为1-3∶1。所述水或有机溶剂或水与有机溶剂的混合溶液的量均优选各按每1g式(V)化合物计算为1~5ml,这里所说的水与有机溶剂的混合溶液指水与有机溶剂以任意比例的混溶,总用量优选按每1g式(V)化合物计算为1~5ml。
所述的碱性条件下可采用下述之一的碱溶液或一种以上的任意组合:氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸氢钾、碳酸钾或者三乙胺、吡啶,N,N-二烷基苯胺、醇钠或者它们的混合物等。碱溶液的pH优选控制在8-12,再优选为8-10。
本发明中合适的有机溶剂如:甲醇、乙醇或者C1-C8醇水任意比例的混合体系,乙酸乙酯、乙酸丁酯等酯类溶剂;丙酮、丁酮、甲基异丁基甲酮等,甲苯、二甲苯、(多)氯(取)代苯等或者二氯甲烷、氯仿等卤代溶剂,DMF,DEF,DMSO,THF,DME,二氧六环、乙腈等或者它们的混合溶剂。有机溶剂优选为下列之一或一种以上的任意组合:甲醇、正丁醇、甲苯。
所述的反应温度优选为30-80℃。
所述反应推荐在相转移催化剂作用下进行,合适的相转移催化剂例如:季铵盐、季膦盐以及PEG200-3000、冠醚等,催化剂用量为反应原料式(V)化合物质量的0.5-5%。所述的相转移催化剂优选如:三乙基苄基氯化铵、PEG400、PEG600、PEG800。
式(I)化合物再经与硫酸作用,可得其硫酸氢盐。
作为本发明的另一实施方式,也可以将式(V)化合物的pH值调节到4~5,以得到式(VI)化合物,式(VI)化合物在合适的催化剂包括如浓硫酸、发烟硫酸、甲磺酸、强酸性树脂以及硫酸氢钠(钾)盐等的作用下在甲醇中进行反应得到式(I)化合物。式(VI)化合物也可与稍过量的酰卤化试剂如SOCl2,PX3,PX5,POCl3,ClCO2R(X=Cl,Br etc.)和至少1当量以上的甲醇及其它溶剂如乙酸乙酯、乙酸丁酯等酯类溶剂;丙酮、丁酮、甲基异丁基甲酮等,甲苯、二甲苯、(多)氯(取)代苯等或者二氯甲烷、二氯乙烷、氯仿等卤代溶剂,DMF,DEF,DMSO,THF,DME,二氧六环、乙腈等或者它们的混合溶剂等,优先选择甲醇为溶剂,在0-100℃反应,或者先单独制备式(VI)化合物的酰卤或(混合)酸酐后与甲醇在0-100℃,优先选择0-70℃反应制备式(X)化合物,它经中和制备得到式(I)化合物,也可以按照其它相关或者类似的条件反应而得,经回收甲醇及过量的酰卤化试剂,按常规后处理得到式(I)化合物。未反应完全的式(VI)化合物经过简单的酸碱等处理和质量检验合格后,可以循环使用。
式(VI)化合物也可以在碱性条件下,例如:碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾、氢氧化钠或者氢氧化钾或者三乙胺、吡啶,N,N-二烷基苯胺、醇钠等或者它们的混合物,在合适的溶剂如水、甲醇、乙醇或者C1-C8醇水混合体系,乙酸乙酯、乙酸丁酯等酯类溶剂;丙酮、丁酮、甲基异丁基甲酮等,甲苯、二甲苯、(多)氯(取)代苯等或者二氯甲烷、氯仿等卤代溶剂,DMF,DEF,DMSO,THF,DME,二氧六环、乙腈等或者它们的混合溶剂等与硫酸二甲酯、一氯甲烷、一溴甲烷、磷酸三甲酯等甲基化试剂在合适的温度条件如0-100℃,优先选择30-80℃,在合适的pH范围如pH=8-12,优先选择pH=8-10,进行反应得到式(I)化合物。相转移催化剂对反应有促进作用,合适的相转移催化剂,例如:季铵盐、季膦盐以及分子量为200-3000的聚乙二醇即PEG200-3000、冠醚等,优先选择三乙基苄基氯化铵、PEG400、PEG600、PEG800,反应6-72小时得到式(I)化合物。当反应在非水体系或者水-有机溶剂混合均相溶剂体系中进行时pH没有要求,碱的用量在1-3当量之间,优先选择1-1.5当量;也可以用适当的方法,先将式(VI)化合物与上述碱在上述或者其它溶剂中反应单独制备式(V)化合物。未反应完全的式(VI)化合物经过简单的酸碱等处理和质量检验合格后,可以循环使用。
本发明提供了一种上述式(V)化合物的制备方法。所述的制备方法包括:式(IV)化合物在碱溶液中、相转移催化剂作用下于60-130℃碱解得所述产物;所述的碱溶液为20-50%的碱水溶液与有机溶剂的混合液;
其中式(IV)中X代表氢、氟、氯、溴或碘原子,优选为2-氯。
相转移催化剂对反应是不可缺少的。没有相转移催化剂,几乎不能或者只能很低收率地水解得到式(V)化合物。本发明由式(IV)化合物制备式(V)化合物的反应中,合适的相转移催化剂例如:季铵盐、季膦盐以及分子量为200-3000的聚乙二醇、冠醚等,优先选择为三乙基苄基氯化铵(TEBA)、PEG400、PEG600或PEG800。催化剂的用量一般为反应原料(IV)化合物质量的0.1%-10%,优先选择0.5%-5%。
所述的有机溶剂如C1-C8的醇或它们的任意组合,优选为下列之一或一种以上的任意组合:甲醇、乙醇、正丁醇,再优选为正丁醇。有机溶剂的用量按每1g式(IV)化合物计算为1~5ml。
碱的浓度对反应是关键,低于20%浓度的氢氧化钠水溶液或者氢氧化钾水溶液或者它们的混合液将只能低收率地得到式(V)化合物。碱的浓度越大,水解越充分、越彻底。碱水溶液优选为35-50%的氢氧化钠或氢氧化钾水溶液或者它们任意比例的混合液。所述碱与式(IV)化合物的当量比为1-20∶1,优选为15-20∶1。
所述的碱解温度优选为90-120℃。
通过控制制备原料,所述的制备方法可以用来制备关键中间体式(V)化合物的光学(手性)异构体及其外消旋体。
本发明还提供了另外一种所述式(V)化合物的制备方法。所述的噻吩并四氢吡啶乙酸盐制备方法包括如下步骤:式(VII)化合物在20-50%的碱水溶液中、相转移催化剂作用下于1-11atm压力条件下、于80-200℃碱解得所述产物;
其中X代表氢、氟、氯、溴或碘原子,优选为2-氯;M为碱金属离子,优选为钠或钾离子。
式(VII)化合物制备式(V)化合物反应中,所述的相转移催化剂如:季铵盐、季膦盐、分子量为200-3000的聚乙二醇、冠醚,优选为:三乙基苄基氯化铵、PEG400、PEG600、PEG800,催化剂用量一般为反应原料式(VII)化合物质量的0.1-10%,优选为0.5-5%。
所述的碱解反应优选在水与有机溶剂的混合溶液中进行,所述的有机溶剂如C1-C8的醇或它们的任意组合,优选为下列之一或一种以上的任意组合:甲醇、乙醇、正丁醇,再优选为正丁醇。有机溶剂的用量按每1g式(VII)化合物计算为1~5ml。
所述碱水溶液的浓度是相当重要的,碱水溶液优选为35-50%的氢氧化钠或氢氧化钾水溶液或它们任意比例的混合液,碱与式(VII)化合物的当量比为1-20∶1,优选为15-20∶1。
所述碱解反应的压力均指绝对压力,优选为1-3atm,反应温度优选为90-120℃。
本发明所述的如式(V)的噻吩并四氢吡啶乙酸盐化合物还可以由式(VI)化合物加碱而得;
其中式(VI)中X代表氢、氟、氯、溴或碘原子,优选为2-氯。
本发明还提供了一种上述式(IV)化合物的制备方法。所述的制备方法包括:式(II)化合物或其盐和式(III)化合物在碱性条件下在有机溶剂中于0-110℃反应,后处理得式(IV)化合物,所述的盐为式(II)化合物的盐酸盐或硫酸盐;
其中式(III)中X为氢、氟、氯、溴或碘原子,优选为2-氯,Y为Br、Cl或酯基,优选为Br或Cl,更优选为Br;所述的酯基优选为下列之一:乙酸酯基、对甲苯磺酰基、甲磺酰基。
所述有机溶剂的用量按每1g式(III)化合物计算通常为1~5ml。所述的有机溶剂如:乙酸乙酯、乙酸丁酯等酯类溶剂;丙酮、丁酮、甲基异丁基甲酮等酮类溶剂,甲苯、二甲苯、(多)氯(取)代苯等或者二氯甲烷、二氯乙烷、氯仿等卤代溶剂,DMF,DEF,DMSO,THF,DME,二氧六环、乙腈,C1~C4的醇如甲醇、乙醇、正丁醇等或者它们的混合溶剂等;所述的有机溶剂优选为甲醇或正丁醇或它们的混合液。
所述的制备反应在碱性条件下进行,采用的碱可为下列之一或一种以上的任意组合:氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸氢钾、碳酸钾、三乙胺、吡啶、N,N-二烷基苯胺、醇钠,优选为碳酸氢钠,碱与式(III)化合物的当量比一般为1-5∶1。
所述的反应优选在50-80℃下进行,反应收率达到85%以上。
通过控制制备原料,所述的制备方法可以用来制备关键中间体式(IV)化合物的光学(手性)异构体及其外消旋体。
上述的式(III)中若Y为Br或Cl,则式(III)化合物可由式(VIII)化合物于80-150℃与卤素经卤代反应而得;
其中式(III)和(VIII)中X代表氢、氟、氯、溴或碘原子,优选为2-氯;Y为Br或Cl。
所述卤代反应的温度优选为100-130℃。
所述卤代反应中卤素与式(VIII)化合物的当量比优选为0.5-1.5∶1,更优选为0.9-1.2∶1。
本发明所述的卤代反应反应完毕,只需经过洗涤、分层等常规的后处理步骤即得取代芳香腈化合物纯品。
上述的式(III)中若Y为酯基,则式(III)化合物可由下述步骤制备而得:式(IX)化合物和酯化试剂在碱性条件下在有机溶剂中于0-100℃进行酯化反应,后处理得式(III)化合物;所述的酯化试剂为酰氯或酸酐或有机酸;
其中式(III)和(IX)中所述的X代表氢、氟、氯、溴或碘原子,优选为2-氯;Y为酯基,优选为下列之一:乙酸酯基、对甲苯磺酰基、甲磺酰基。
所述的酯化试剂如对甲苯磺酰氯、甲磺酰氯、酸酐、醋酸、乙酰氯等,优选为对甲苯磺酰氯或甲磺酰氯。酯化试剂与式(IX)化合物的当量比优选为1-1.2∶1。
所述的有机溶剂如下列之一或一种以上的任意组合:乙酸乙酯、乙酸丁酯、丙酮、丁酮、甲基异丁基甲酮、甲苯、二甲苯、氯代苯、二氯甲烷、二氯乙烷、氯仿、DMF、DEF、DMSO、THF、DME、二氧六环、乙腈。有机溶剂优选为下列之一或一种以上的任意组合:乙酸丁酯、甲苯、二甲苯、氯代苯、乙腈。
所述反应在碱性条件下进行,可采用下列之一的碱或一种以上的任意组合:氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸氢钾、碳酸钾、三乙胺、吡啶,N,N-二烷基苯胺,优选采用下列之一的碱或一种以上的任意组合:氢氧化钠、氢氧化钾、三乙胺、N,N-二甲基苯胺。所述的碱与式(IX)化合物的当量比一般为1-5∶1。
所述的酯化反应温度优选为0-30℃。
本发明所述的制备方法中,各反应产物中间体既可以直接用于下一化合物的制备,也可以先行分离和纯化后,再进行下一化合物的制备。如制备式(I)化合物时,既可以将式(V)化合物的反应液直接用于制备式(I)化合物,也可以分离、纯化得到式(V)化合物后再进行式(I)化合物的制备。同时,通过控制各制备原料,本发明所述的各制备方法可以用来制备关键中间体式(III)、(IV),(V)及(VI)化合物的光学(手性)异构体及其外消旋体。
本发明提供了制备式(I)化合物的方法,同时还提供了其关键中间体式(III)、(IV),(V)及(VI)化合物的光学(手性)异构体及其外消旋体的制备方法。本发明提供的制备方法具有原料易得,反应简单、温和、操作简便,有害试剂及溶剂种类和用量少,工艺简单、环保,单程及多程收率高(每步收率都在80%以上)、中间体及中间过程可以分开进行,也可以不严格分离或者分开,进行“一锅”法反应等特点。
附图说明具体实施方式(四)具体实施方式
为了充分说明本发明专利的实质、制备思路及构思,在下述实施例中验证本发明所述的制备方法,这些实施例仅供举例说明和特例代表,不应被解释或理解为对本发明保护范围的限制。
实施例1(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈60g,40%氢氧化钾360g,正丁醇200ml,相转移催化剂TEBA1.2g加热回流(约115℃)反应8小时左右,冷却到室温,(加20%左右盐酸中和体系pH 11左右,冷却到室温,加水搅拌使体系盐刚好溶解,(加乙酸丁酯约50×2ml萃取少量未水解完毕的中间产物——酰胺),水层再次调节pH 9,补加正丁醇100-150ml,室温滴加硫酸二甲酯120g,约半小时滴加完毕,继续室温反应2小时,其间调节并维持体系pH 9,升温到约45℃反应8小时以上,然后回流反应2小时,冷却,分离有机层,水层50×2ml丁醇萃取,合并有机层,水洗,干燥,去溶剂,得高纯度氯吡格雷碱粗品,两步单程收率约40%;油状物与98%的硫酸在丙酮中反应,得其硫酸氢盐。
水层可以按以下方法处理回收未充分反应的酸,实现多程循环套用:
将水层中和精密调节pH4-4.5,低温冷却得到酸,粗酸经过[水洗(结晶)等]除盐处理后,可以按以上方法调节pH后继续多次循环酯化;由于酸室温在正丁醇中有较大溶解度,也可以在调节到体系pH4-4.5后,加入正丁醇(和适量水使盐溶解)加热(酸在醇中溶解有一个过程)萃取,然后冷却到10℃左右,分离丁醇层,水层再补充搅拌萃取,去溶剂得到酸,然后循环套用。
实施例2(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
将40%的氢氧化钠溶液360g和100ml的甲醇,60g的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈,相转移催化剂TEBA 1.0g置于合适的反应瓶中,然后体系回流反应12个小时,停止反应。冷却过滤,得到(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g。
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,水250ml,相转移催化剂TEBA 1.2g,用NaOH调节体系pH=10左右,加入甲苯200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例3(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
依实施例2所述方法得到(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g。
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例4(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
依实施例2所述方法得到(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g。
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,相转移催化剂TEBA 1.2g溶于250ml的甲醇中,然后加入60g的20%氢氧化钠溶液,将体系搅拌回流30分钟,然后冷却到10℃左右,慢慢滴加入40g的硫酸二甲酯,滴加完毕,将体系升温至20~25℃反应两个小时,再将体系升温至40℃左右反应12个小时,最后停止反应,回收甲醇,加入50ml的乙酸丁酯并用水洗涤多次,干燥,减压脱除乙酸丁酯,得油状目标产物28g(收率47%)。
实施例5(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
有机溶剂改为正丁醇,其它同实施例2,得油状目标产物26g(收率44%)。
实施例6(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
有机溶剂改为甲苯,其它同实施例3,得油状目标产物28g(收率47%)。
实施例7(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
相转移催化剂改为0.4g 18-冠-6,其它同实施例3,得油状目标产物30g(收率50%)。
实施例8(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
(1)(±)α-溴代邻氯苯乙腈的制备
将151.5g(1mol)的邻氯苯乙腈置于500ml的三口烧瓶中,体系升温至110℃,维持温度开始滴加176g(1.1mol)溴素,在三个小时内滴加完毕。继续保持在此条件下搅拌反应三个小时,然后将反应体系冷却到30℃以下,加入水400毫升,充分搅拌洗涤(HBr)5分钟,静置,分层,有机层加入5%左右的亚硫酸氢钠溶液少许洗涤,搅拌15分钟,然后静置分层。有机层用水洗涤至近中性,得红棕色油状物225g,(沸点:-110℃/15mmHg;IR:2969,2253,1472;1HNMR:5.87s,7.42m;7.83t)(收率96%),直接用于下一步反应。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
将98.65g(0.428mol)的α-溴代邻氯苯乙腈,300ml甲醇,84g(1.0mol)碳酸氢钠和4,5,6,7-四氢噻吩并[3,2-c]吡啶盐酸盐70.2g 2(0.4mol)投入到合适的反应瓶中,然后将体系回流反应3个小时以上直到TLC检测主原料点消失。反应完毕,将体系冷却至0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体98g(收率85%)。不用结晶提纯,可以直接进行下一步反应。
所得产物用IR光谱、质谱、13C-NMR和1H-NMR鉴别如下:
IR光谱(cm-1):2227(w,-CN)
质谱(m/z):289.1(M+H)+
13C-NMR(CDCl3):δ136.46,132.78,132.38,130.69,130.46,130.38,129.90,126.73,124.96,123.01,115.09,59.12,49.30,47.66,25.47
1H-NMR(CDCl3):δ7.2-7.7(4H,m),7.0(1H,d),6.69(1H,d),5.32(1H,s),3.78(1H,d),3.65(1H,d),2.8-3.0(4H,m)
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
将40%的氢氧化钠溶液360g和100ml的甲醇,60g的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈,相转移催化剂TEBA 1.0g置于合适的反应瓶中,然后体系回流反应12个小时,停止反应。冷却过滤,得产物61g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐61g,水250ml,相转移催化剂TEBA 1.2g,用NaOH调节体系pH=10左右,加入甲苯200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例9(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
(1)(±)α-氯代邻氯苯乙腈的制备
改为缓慢通氯气80g,通气时间6小时,其它同实施例8步骤(1)。得粗品172g,收率92.5%,粗品经过蒸馏得产品159g,收率85.5%。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
α-溴代邻氯苯乙腈改为α-氯代邻氯苯乙腈,以正丁醇为溶剂,其它同实施例1步骤(2)。将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷丁醇洗涤,干燥得浅黄色细颗粒状固体99.2g(收率86%)。不用结晶提纯,可以直接进行下一步反应。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
同实施例8步骤(3),但以正丁醇为溶剂,得到式(V)化合物63g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,水250ml,相转移催化剂TEBA 1.2g,用NaOH调节体系pH=10左右,加入甲苯200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例10(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
(1)(±)α-氯代邻氯苯乙腈的制备
同实施例9步骤(1)。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
以α-氯代邻氯苯乙腈替代α-溴代邻氯苯乙腈,以甲醇为溶剂,其它同实施例1步骤(2)。反应完毕,将体系冷却0-5℃,过滤,滤饼用水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体94.5g(收率82%),不用结晶提纯,可以直接进行下一步反应。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
将50%的氢氧化钠溶液320g和100ml的甲醇,60g的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈,相转移催化剂TEBA,1.0g置于合适的反应瓶中,然后体系回流反应15个小时,停止反应。冷却过滤,得产物61g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,水250ml,相转移催化剂TEBA 1.2g,用NaOH调节体系pH=10左右,加入甲苯200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例11(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
(1)(±)邻氯扁桃腈对甲苯磺酸酯的制备
将16.8g(0.1mol)的邻氯扁桃腈,21g(0.11mol)的对甲苯磺酰氯,80ml的乙腈混合加入合适的反应瓶中,0-25℃滴加20g(0.2mol)的三乙胺,室温反应5小时后,将体系回流,用薄层层析板跟踪反应。反应完成后,回收乙腈。然后向反应体系中加入乙酸丁酯萃取,并用水多次洗涤,减压脱除乙酸丁酯,得目标产物30g(93.75%)。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
以(±)邻氯扁桃腈对甲苯磺酸酯替代α-溴代邻氯苯乙腈,以甲醇为溶剂,其它同实施例8步骤(2)。反应完毕,将体系冷却0-5℃,过滤,滤饼用冷水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体102.5g(收率89%),不用结晶提纯,可以直接进行下一步反应。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
将35%的氢氧化钠溶液360g和100ml的甲醇,60g的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈,相转移催化剂TEBA,1.0g置于合适的反应瓶中,然后体系回流反应12个小时,停止反应。冷却过滤,得产物61g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐61g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例12(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
(1)(±)邻氯扁桃腈对甲苯磺酸酯的制备
将16.8g(0.1mol)的邻氯扁桃腈,21g(0.11mol)的对甲苯磺酰氯,100ml的甲苯混合加入合适的反应瓶中,0-5℃滴加100g 5%NaOH(0.125mol)溶液,10-15℃继续反应,用薄层层析板跟踪反应,反应完成后,分离甲苯层,50×2ml(萃取两次,每次50ml)甲苯萃取碱层。水洗甲苯层,减压脱除甲苯,得目标产物29g(90.6%)。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
同实施例11步骤(2)。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
将45%的氢氧化钠溶液360g和100ml的甲醇,60g的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈,相转移催化剂TEBA,1.0g置于合适的反应瓶中,然后体系回流反应14个小时,停止反应。冷却过滤,得产物61g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐61g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例13(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
(1)(±)邻氯扁桃腈对甲苯磺酸酯的制备
100g 5%NaOH(0.125mol)溶液替换为100g 8%的KOH(0.14mol)溶液,其它同实施例12步骤(1),得目标产物29g(90.6%)。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
同实施例12步骤(2)。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
同实施例8步骤(3),但以正丁醇为溶剂,得产物63g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例14(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
(1)(S)-邻氯扁桃腈对甲苯磺酸酯的制备
将16.8g(0.1mol)的(S)-邻氯扁桃腈,21g(0.11mol)的对甲苯磺酰氯,100ml的乙酸丁酯混合加入合适的反应瓶中,0-5℃滴加10ml N,N-二甲基苯胺,20-25℃继续反应3小时,将体系回流,用薄层层析板跟踪反应,反应完成后,冷却,加5%稀盐酸50ml,室温搅拌,分出乙酸丁酯层,50×2ml水洗乙酸丁酯层,减压脱除乙酸丁酯,得目标产物31g(96.9%)。
(2)(S)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
以(S)-邻氯扁桃腈对甲苯磺酸酯代替(±)邻氯扁桃腈对甲苯磺酸酯,其它同实施例4步骤(2)。,得产品102.5g(收率89%),ee.>99%。(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
将50%的氢氧化钠溶液320g和100ml的甲醇,60g的(S)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈,相转移催化剂18冠6,1.0g置于合适的反应瓶中,然后体系回流反应12个小时,停止反应。冷却过滤,得产物61g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(S)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐61g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例15(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钾盐的制备
(1)(±)α-氯代邻氯苯乙腈的制备
同实施例9步骤(1)。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
同实施例9步骤(2)。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钾盐的制备
以40%的氢氧化钾溶液360g为碱,正丁醇为溶剂,其它同实施例8步骤(3)。得产物70g,不经过纯化,可直接用于后步反应。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钾盐63g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例16(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
(1)(±)邻氯扁桃腈甲磺酸酯的制备
将21g对甲苯磺酰氯替换为13g甲磺酰氯,其它步骤同实施例4步骤(1),得目标产物24g(97.6%)。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
以邻氯扁桃腈甲磺酸酯替代邻氯扁桃腈对甲苯磺酸酯,以甲醇为溶剂,其它同实施例11步骤(2)。反应完毕,将体系冷却0-5℃,过滤,滤饼用冷水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体104.1g(收率90.3%),不用结晶提纯,可以直接进行下一步反应。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
以相转移催化剂18冠6,0.20g代替TEBA,其它同实施例11步骤(3),得产物62g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐62g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例17(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
(1)(±)邻氯扁桃腈甲磺酸酯
将21g对甲苯磺酰氯替换为13g甲磺酰氯,其它步骤同实施例11步骤(1),得目标产物24g(97.6%)。
(2)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈
同实施例11步骤(2)。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐
以相转移催化剂18冠6,0.20g替代TEBA,其它同实施例9步骤(3),得式(V)化合物63g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例18(R)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
(1)(R)-邻氯扁桃腈对甲苯磺酸酯
以(R)邻氯扁桃腈代替邻氯扁桃腈,其它同实施例9步骤(1),得目标产物(R)-邻氯扁桃腈对甲苯磺酸酯160g。ee,99%min.
(2)(R)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
以(R)-邻氯扁桃腈对甲苯磺酸酯替代α-溴代邻氯苯乙腈,以甲醇为溶剂,其它同实施例8步骤(2)。反应完毕,将体系冷却0-5℃,过滤,滤饼用冷水充分搅拌洗涤,然后再用冷甲醇洗涤,干燥得浅黄色细颗粒状固体102.5g(收率89%)。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
以正丁醇为溶剂,其它同实施例8步骤(3),得产物63g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例19(S)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
(1)(S)-邻氯扁桃腈甲磺酸酯
以(S)-邻氯扁桃腈代替邻氯扁桃腈,其它同实施例9步骤(1),得目标产物(S)-邻氯扁桃腈甲磺酸酯23g。ee,99%min.
(2)(S)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈的制备
以(S)-邻氯扁桃腈甲磺酸酯替代邻氯扁桃腈甲磺酸酯,其它同实施例9步骤(2)。
(3)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐的制备
步骤(2)物料反应完毕后,冷却,加入35%的氢氧化钠溶液600g,相转移催化剂TEBA,1.5g置于合适的反应瓶中,然后体系回流反应12个小时,停止反应。冷却过滤,得产物108g。
(4)(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐63g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
实施例20(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
将35%的氢氧化钾溶液360g和100ml的正丁醇,64g的(S)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙腈,相转移催化剂TEBA,1.0g置于合适的反应瓶中,然后体系回流反应10个小时,停止反应。冷却过滤,得产物(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钾盐64g。
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钾盐63g,水250ml,相转移催化剂PEG4001.5g,用NaHCO3调节体系pH=10左右,加入正丁醇200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯32g(收率51%)。
实施例21(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸甲酯的制备
将50%的氢氧化钠溶液320g和100ml的甲醇,61g的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酰胺,相转移催化剂TEBA,1.0g置于合适的反应瓶中,然后体系回流反应18个小时,停止反应。冷却过滤,得到(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐61g,收率93%。
取上述得到的(±)-(2-氯苯基)-(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙酸钠盐61g,水250ml,相转移催化剂TEBA 1.2g,用NaOH调节体系pH=10左右,加入甲苯200ml,在10℃滴加120g硫酸二甲酯,自然升温到室温并反应5小时,然后于40℃反应26小时,反应过程中始终维持体系pH=10左右,反应结束后,分离有机层或者用乙酸丁酯多次萃取,合并有机层,将其用水洗涤多次,干燥,减压脱除溶剂,得为油状物的目标产物32g(收率51%)。
一种噻吩并四氢吡啶乙酸甲酯化合物的制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0