专利摘要
本发明公开了一种六钒酸‑L‑丙氨酸甲酯衍生物及其制备方法与应用,属于有机无机杂化材料技术领域。本发明的六钒酸‑L‑丙氨酸甲酯酯衍生物具有抗肿瘤活性,其结构式为:[Bu4N]2[V6O13{(OCH2)3CCH2OOCCH2CH2CONHCH(CH3)CH2COOCH3}2];其制备方法包括如下步骤:在六钒酸丁二酸衍生物的乙腈溶液中加入1‑(3‑二甲氨基丙基)‑3‑乙基碳二亚胺盐酸盐、1‑羟基苯并三唑、L‑丙氨酸甲酯盐酸盐、三乙胺,溶解完全后在48~52℃下反应40~50小时,得到六钒酸‑L‑丙氨酸甲酯衍生物。本发明在药物化学领域具有重大的研究价值和应用前景,为进一步药物开发提供了方向。
权利要求
1.一种六钒酸-L-丙氨酸甲酯衍生物,其特征在于:结构式如下:
[Bu
2.权利要求1所述的六钒酸-L-丙氨酸甲酯衍生物的制备方法,其特征在于:包括如下步骤:在六钒酸丁二酸衍生物的乙腈溶液中加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1-羟基苯并三唑、L-丙氨酸甲酯盐酸盐、三乙胺,溶解完全后在48~52℃下反应40~50小时,得到六钒酸-L-丙氨酸甲酯衍生物。
3.根据权利要求2所述的制备方法,其特征在于:所述的六钒酸丁二酸衍生物通过包括如下步骤的方法制备得到:(1)将偏钒酸钠与季戊四醇在水溶液中加热至78~82℃,在pH=2~3的条件下反应45~55小时,将反应后的溶液过滤,得滤液滴入四丁基溴化铵溶液中,得到六钒酸季戊四醇衍生物;(2)将六钒酸季戊四醇衍生物、丁二酸酐、三乙胺以及4-二甲氨基吡啶在48~52℃条件下反应40~50小时,得到六钒酸丁二酸衍生物。
4.权利要求1所述的六钒酸-L-丙氨酸甲酯衍生物在制备抗肿瘤药物中的应用。
5.一种抗肿瘤药物,其特征在于:包含权利要求1所述的六钒酸-L-丙氨酸甲酯衍生物。
6.根据权利要求5所述的抗肿瘤药物,其特征在于:包含所述六钒酸-L-丙氨酸甲酯衍生物药学上允许的载体或赋形剂。
7.根据权利要求5所述的抗肿瘤药物,其特征在于:所述抗肿瘤药物的剂型包括颗粒剂、片剂、丸剂、胶囊、注射剂、悬浮剂或乳剂。
说明书
技术领域
本发明涉及有机无机杂化材料的技术领域,具体涉及一种六钒酸-L-丙氨酸甲酯衍生物及其制备方法与应用。
背景技术
多金属氧酸盐是一类由Mo、W、V、Nb和Ta等5种前过渡元素组成的,具有确定结构的金属-氧簇化合物,到目前为止主要包含六种经典结构的多酸阴离子,即杂多酸Keggin、Anderson、Well-Dawson、Waugh、Silverton和同多酸Lindqvist。由于多金属氧酸盐具有丰富的结构和特殊的物理化学性质,使其表现出很多优异性能,在药物化学、催化化学、结构化学、超分子化学、新功能材料科学、光电化学、磁化学、生物化学、手性仿生、能源及环境等领域均有着广泛的研究价值及应用前景。目前最为引人注目的是多酸的药物化学的研究,到目前为止,已报道的各种具有药物活性的多酸化合物有两百多种,在抗病毒活性、抗肿瘤活性、抗菌活性等显示出良好的性能,特别是近年来,多酸的抗病毒研究已经取得重大进展,目前多酸作用的病毒种类主要包括人体免疫缺陷病毒(HIV)、单纯疱疹病毒(HSV)、流感病毒(fluV)、B型肝炎病毒和SARS病毒等。
相比于纯多酸的药物化学的研究,多酸有机衍生物的药物化学更具有研究意义,将多酸簇与有机分子连接不但能够增加多酸的生物相容性,降低其毒副作用,而且多酸簇与有机基团产生的协同作用还可能增强其药物活性。Yamase组在1999年报道了[CoW11O39(CpTi)]
发明内容
本发明的目的在于提供一种具有抗肿瘤活性的六钒酸-L-丙氨酸甲酯酯衍生物。本发明的目的还在于提供所述六钒酸-L-丙氨酸甲酯酯衍生物的制备方法,以及其在制备抗肿瘤药物中的应用。
本发明的目的通过下述技术方案实现:
一种六钒酸-L-丙氨酸甲酯衍生物,其结构式如下:
[Bu4N]2[V6O13{(OCH2)3CCH2OOCCH2CH2CONHCH(CH3)CH2COOCH3}2]。
所述的六钒酸-L-丙氨酸甲酯衍生物为三斜晶系,化合物晶胞参数为: α=90.00°,β=111.35°,γ=90.00°。
所述的六钒酸-L-丙氨酸甲酯衍生物的制备方法,包括如下步骤:在六钒酸丁二酸衍生物的乙腈溶液中加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1-羟基苯并三唑、L-丙氨酸甲酯盐酸盐、三乙胺,溶解完全后在48~52℃下反应40~50小时,得到六钒酸-L-丙氨酸甲酯衍生物。
其中,所述的六钒酸丁二酸衍生物优选通过包括如下步骤的方法制备得到:(1)将偏钒酸钠与季戊四醇在水溶液中加热至78~82℃,在pH=2~3的条件下反应45~55小时,将反应后的溶液过滤,滤液滴入四丁基溴化铵溶液中,得到六钒酸季戊四醇衍生物,即[Bu4N]2[V6O13{(OCH2)3CCH2OH}2];(2)将六钒酸季戊四醇衍生物、丁二酸酐、三乙胺以及4-二甲氨基吡啶在48~52℃条件下反应40~50小时,得到六钒酸丁二酸衍生物,即[Bu4N]2[V6O13{(OCH2)3CCH2OOCCH2CH2COOH}2]。
所述的六钒酸-L-丙氨酸甲酯衍生物对多种肿瘤细胞具有很好的抑制作用,其具有制备抗肿瘤药物的应用。
一种抗肿瘤药物,包含所述的六钒酸-L-丙氨酸甲酯衍生物,还可以包含所述六钒酸-L-丙氨酸甲酯衍生物药学上允许的载体或赋形剂。所述的抗肿瘤药物的剂型包括颗粒剂、片剂、丸剂、胶囊、注射剂、悬浮剂、乳剂,可通过常规方法制成这些药剂。
本发明具有以下优点和有益效果:
(1)本发明的六钒酸-L-丙氨酸甲酯衍生物稳定性强、生物相容性好,其抗肿瘤活性好,其对多种肿瘤细胞具有显著的抑制活性,特别是对人类横纹肌瘤细胞的抗肿瘤效果远远优于抗肿瘤药物5-氟尿嘧啶(5-Fu)。
(2)本发明的六钒酸-L-丙氨酸甲酯衍生物制备方式简单,反应条件温和、原子经济性高、产率较高及对环境友好,易于大规模生产药物。
(3)本发明在药物化学领域将具有重大的研究价值和应用前景,为进一步药物开发提供了有价值的导向作用。
附图说明
图1是六钒酸‐L‐丙氨酸甲酯衍生物的阴离子结构图。
图2是六钒酸‐L‐丙氨酸甲酯衍生物的合成过程示意图。
图3是六钒酸‐L‐丙氨酸甲酯衍生物的热重分析折线图。
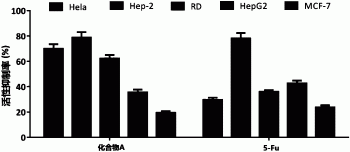
图4是六钒酸‐L‐丙氨酸甲酯衍生物(50μmol/L)对不同肿瘤细胞抑制活性的结果图。
图5是六钒酸‐L‐丙氨酸甲酯衍生物对肿瘤细胞Hela、RD的抑制率随浓度变化的曲线图,作图为Hela细胞,右图为RD细胞。
图6是六钒酸‐L‐丙氨酸甲酯衍生物引起的Hela细胞的病变效应显微图,左图为空白对照,右图为病变细胞。
图7是六钒酸‐L‐丙氨酸甲酯衍生物引起的RD细胞的病变效应显微图,左图为空白对照,右图为病变细胞。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1六钒酸-L-丙氨酸甲酯衍生物的合成方法
六钒酸-L-丙氨酸甲酯衍生物的阴离子结构如图1所示,为Linqivist型六钒酸,其中的钒全部为+5价,六钒酸上的氧原子被两个三羟甲基类化合物分子的羟基氧所取代,其中每个三羟甲基类化合物上三个羟基氧取代六钒酸上三个排布呈平面三角形的桥氧原子,两个三羟甲基类化合物相对分布在六钒酸骨架上,氨基酸酯通过酰胺键与三羟甲基化合物共价连接。
六钒酸-L-丙氨酸甲酯衍生物的合成分三步进行,其合成过程示意图如图2所示。
(1)[Bu4N]2[V6O13{(OCH2)3CCH2OH}2]六钒酸季戊四醇衍生物的合成
称取5g(41mmol)偏钒酸钠,加入至100mL干燥的圆底烧瓶中,向烧瓶中加入50mL去离子水,加热至80℃使其溶解完全,得到透明的浅黄色溶液。向溶液中不断滴加1mol/L的盐酸,使得溶液的pH调节至2~3,再加入3.72g(27.3mmol)季戊四醇,在80℃下恒温油浴搅拌,反应48h。称量10g的四丁基溴化铵,溶于50mL水中。将反应后的混合液过滤,过滤得到的滤液滴入四丁基溴化铵溶液中,产生大量的红棕色沉淀,过滤后得到红棕色固体,即六钒酸季戊四醇衍生物。
(2)中间产物[Bu4N]2[V6O13{(OCH2)3CCH2OOCCH2CH2COOH}2]六钒酸丁二酸衍生物(化合物1)的合成
称取6.32g(5mmol)六钒酸季戊四醇衍生物,加入至250mL干燥的圆底烧瓶中,向烧瓶中加入100mL无水乙腈,加热至使其溶解完全,得到深红色溶液。向溶液中加入1.6g(16mmol)丁二酸酐、1g(10mmol)三乙胺以及0.08g(0.65mmol)4-二甲氨基吡啶(DMAP),在50℃下恒温油浴搅拌,反应48h。冷却至室温,将反应液过滤,滤液静置5d析出深红色块状晶体,即六钒酸丁二酸衍生物(化合物1)。
(3)[Bu4N]2[V6O13{(OCH2)3CCH2OOCCH2CH2CONHCH(CH3)CH2COOCH3}2]六钒酸-L-丙氨酸甲酯衍生物(化合物A)的合成
称取0.732g(0.5mmol)六钒酸丁二酸衍生物(化合物1)、0.192g(1.0mmol)1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、0.135g(1.0mmol)1-羟基苯并三唑、0.139g(1.0mmol)L-丙氨酸甲酯盐酸盐加入50mL圆底烧瓶中,然后加入30mL无水乙腈和0.2g(2mmol)三乙胺,溶解完全后将烧瓶置于50℃油浴锅中搅拌反应48h,再将反应混合液过滤,滤液滴到干净烧杯中置于通风橱中,3天后将得到的油状物用去离子水洗涤可以得到深红色固体的粗产物,粗产物用二氯甲烷和乙腈的混合液(体积比5:1)溶解,过滤除去不溶物,混合液置于试管中,缓慢加入正丁醚(体积为混合液的5倍),将试管塞紧静置3天可以得到红色片状晶体,即为六钒酸-L-丙氨酸甲酯衍生物(化合物A)。IR(KBr-pellets,cm
六钒酸-L-丙氨酸甲酯衍生物的热重分析如图3,其在169℃时开始出现分解,到800℃分解65%以上。
实施例2抗肿瘤活性评价
(1)化合物的体外抗肿瘤活性评价
供试肿瘤细胞:人类肝癌细胞HepG2、人类横纹肌瘤细胞RD、人类宫颈癌细胞Hela、人类喉癌细胞Hep-2,人类乳腺癌细胞MCF-7。
细胞培养:GIBCO DMEM培养基,10%胎牛血清和0.01%L-谷氨酰胺配制成培养液。培养的细胞株置于37℃、5%CO2饱和湿度下常规培养传代,实验均用处于对数生长期的细胞。
体外抗肿瘤活性评价(MTT法):将以上肿瘤细胞分别铺板96孔板,在37℃、5%CO2培养箱培养长满单层后,弃去细胞培养液,分别加含不同浓度测试化合物的细胞维持液(含血清2%和0.002%L-谷氨酰胺)继续培养,以未经药物作用的细胞作为空白对照,以抗肿瘤药物5-氟尿嘧啶(5-Fu)为阳性对照,每组设8个复孔,继续培养48h。显微镜目测并分别记录细胞状况,每孔加MTT(5mg/mL)20μL继续培养4h,弃上清液,每孔加150μL DMSO,37℃孵育10min,酶标仪检测490nm波长处的吸光值(A490)。按以下公式计算平均抑制率:
抑制率=(细胞对照组平均OD490值-药物组平均OD490值)/细胞对照组平均OD490值)×100%。
测试结果表明,上述化合物A(六钒酸-L-丙氨酸甲酯衍生物)对于Hela、HepG2、Hep-2、RD、MCF-7肿瘤细胞增殖都有较强的抑制活性,其半数抑制浓度IC50如表1所示。
表1化合物A、5-Fu对不同肿瘤细胞半数抑制浓度IC50(μmol/L)
50μmol/L化合物A对于不同肿瘤细胞的抑制活性如图4所示,在50μmol/L时化合物A对于Hela、Hep-2和RD肿瘤细胞表现出较强的抑制效果,阳性对照对照药物5-Fu对于各种肿瘤细胞的抑制率相对较低;特别是对于Hela、RD细胞,化合物A抑制作用远远强于5-Fu。其中,不同浓度的化合物A抑制Hela、RD细胞的活性如图5所示,化合物A对RD细胞和Hela细胞呈现浓度依赖的抑制活性,在足够浓度的情况下可以达到使肿瘤细胞完全凋亡致死的效果。
(2)化合物引起的肿瘤细胞病变效应
进一步用显微镜拍照记录代表化合物A引起的Hela、RD细胞的细胞病变效应,具体实施方法如下:
将对数生长期的肿瘤细胞铺板96孔板,在37℃、5%CO2培养箱培养长满单层后,弃去细胞培养液,分别加含50μmol/L化合物A的细胞维持液继续培养,48h时显微镜目测并拍照细胞病变情况。
化合物A引起的肿瘤细胞病变效应如图6、7所示。显微镜下未做处理的肿瘤细胞生长良好,贴壁牢固,形态饱满,边缘界限清晰。50μmol/L化合物A处理48h即导致所有的肿瘤细胞凋亡,细胞以不同形式变圆,从培养板脱落。可见化合物A对于RD细胞和Hela细胞具有抑制生长效应。
由上述内容可知,本发明的六钒酸‐L‐丙氨酸甲酯衍生物具有很好的抑制不同种肿瘤细胞增殖的作用,能够用于制备抗肿瘤药物。六钒酸‐L‐丙氨酸甲酯衍生物在将来的药物开发中具有很大潜力,在进一步临床上进行研究后,有希望用来制备对应的抗肿瘤药物,为抗肿瘤药物提供一种全新的选择。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
一种六钒酸-L-丙氨酸甲酯衍生物及其制备方法与应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0