专利摘要
本发明涉及一种利用离子液体高效提取雷公藤内酯酮的方法,该方法包括以下步骤:1)超声强化提取;2)有机溶剂萃取:按提取液、水与脂肪族羧酸酯的体积比1~5:1~3:1萃取,有机相减压浓缩至近干得雷公藤浸膏;3)柱层析净化:上述浸膏与硅胶充分混合后装柱,经乙醚淋洗,以及乙醚‑乙酸乙酯混合溶剂洗脱挥干后得雷公藤内酯酮粗品;4)HSCCC分离纯化:选择HSCCC溶剂系统,以离子液体Ⅱ作为流动相添加剂,经HSCCC分离纯化得雷公藤内酯酮溶液;5)真空冷冻干燥。该方法大大减少了有机溶剂的使用,显著降低了提取过程中的污染和危害,改善了提取效果和效率,并且离子液体能大大缩短了HSCCC的分离时间,得到的雷公藤内酯酮的纯度大于95%。
权利要求
1.用离子液体高效提取雷公藤内酯酮的方法,其特征在于由以下步骤组成:
1)超声强化提取:含雷公藤内酯酮的植物原料经干燥粉碎后过40~80目筛,按固液比1:5~50加入体积比为10:0.1~0.8:2~10的乙醇、水和咪唑类离子液体Ⅰ混合液,于超声功率密度10~200W/cm
2)有机溶剂萃取:将脂肪族羧酸酯和一定量的水加入到所述步骤1)得到的提取液中,按提取液、水与脂肪族羧酸酯的体积比1~5:1~3:1萃取1~5次;分离有机相得雷公藤内酯酮萃取相,然后将得到的有机萃取相在40~60℃下减压浓缩至近干,得到含有雷公藤内酯酮的浸膏;萃取余液循环使用,该萃取余液主要成分 为上述咪唑类离子液体Ⅰ;
3)柱层析净化:将得到的含有雷公藤内酯酮的浸膏与200~300目的硅胶按重量比1:10~100进行充分混合,然后装入一支底部具有筛板的玻璃层析柱中,先用适量乙醚淋洗,再用体积比为4:1的乙醚与乙酸乙酯混合溶剂洗脱,控制洗脱液的流速不大于10mL/min,收集洗脱液,然后将得到的洗脱液在40~60℃下减压浓缩至近干,得到雷公藤内酯酮粗品;
4)HSCCC分离纯化:选择HSCCC溶剂体系,所述HSCCC溶剂体系为体积比为2:3:3:1∶0.05的正己烷-醋酸乙酯-甲醇-水-咪唑离子液体Ⅱ配制的HSCCC溶剂体系、体积比为2:3:3:2∶0.05的甲基叔丁基醚-正丁醇-乙醇-水-咪唑离子液体Ⅱ配制的HSCCC溶剂体系或者体积比为1:2:2:2∶0.05正己烷-醋酸乙酯-乙醇-水-咪唑离子液体Ⅱ配制的HSCCC溶剂体系中的任意一种,所述咪唑类离子液体Ⅱ为1-丁基-3-甲基咪唑六氟磷酸盐、1-乙基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑四氟硼酸盐、1-乙基-3-甲基咪唑六氟磷酸盐中的至少一种,按体积/重量比0.2~2:1,单位为mL/mg将HSCCC溶剂体系和上述雷公藤内酯酮粗品加入到分液漏斗中,震荡、静置分层,平衡后,将上、下相分开,以溶剂体系的上相为固定相,溶剂体系的下相为流动相,调整转速,以一定流速泵入流动相,根据检测器的谱图分步收集目标物,分别获得雷公藤内酯酮的溶液;
5)真空冷冻干燥:将上述各雷公藤内酯酮溶液,在适当温度、干燥压力下真空冷冻干燥,回收有机萃取剂,分别得到纯度大于95%的雷公藤内酯酮;所述咪唑类离子液体Ⅰ为1-烯丙基-3-甲基咪唑氯盐、1-乙基-3-甲基咪唑氯盐、1-丁基-3-甲基咪唑溴盐、1-乙基-3-甲基咪唑溴盐、1-辛基-3-甲基咪唑氯盐中的至少一种。
2.如权利要求1所述的利用离子液体高效提取雷公藤内酯酮的方法,其特征在于:所述步骤1)中乙醇、水和咪唑类离子液体Ⅰ混合液的体积比为10:0.5:5。
3.如权利要求1所述的利用离子液体高效提取雷公藤内酯酮的方法,其特征在于:所述脂肪族羧酸酯为甲酸甲酯、乙酸乙酯、乙酸丙酯、乙酸丁酯和甲酸乙酯中的一种。
说明书
技术领域
本发明涉及制药工程技术领域,尤其涉及一种利用离子液体超声高效提取、高速逆流色谱分离纯化雷公藤内酯酮的方法。
背景技术
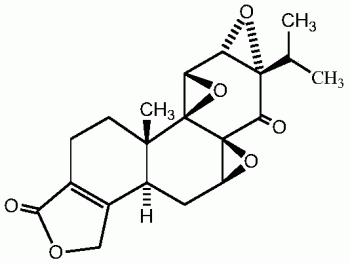
雷公藤(Tripterygium wilfordii Hook.f.)为卫矛科雷公藤属植物,临床上已广泛用于治疗类风湿性关节炎、肾病综合征、系统性红斑狼疮等多种自身免疫疾病,其见效快、疗效确切,几乎没有可以完全替代的类似中药。雷公藤内酯酮(Triptonide),又叫雷公藤羰内酯、雷公藤酮,是从雷公藤中分离得到的一个二萜类化合物,是雷公藤的有效成份之一,它与雷公藤内酯醇结构相似,活性也相当,其结构式如下。雷公藤内酯酮具有抗雄性生育作用和对免疫功能具有一定的影响。因此,开展雷公藤内酯酮的分离提纯技术研究对未来新药的研发具有深远的影响。
离子液体在化学领域的独特性能已得到了广泛的关注,目前在天然产物的提取分离中已得到了较好的应用,如专利号为ZL200810114416.0的中国发明专利《一种离子液体高效提取生产青蒿素的新方法》利用咪唑类离子液体卤化物盐与水的混合物超声强化提取青蒿原料中的青蒿素。目前关于利用离子液体从雷公藤植物原料中提取雷公藤内酯酮的方法还未见报道,因此,开展雷公藤内酯酮的离子液体提取纯化研究,对解决当前雷公藤内酯酮的分离技术问题具有重要的现实意义。
发明内容
本发明所要解决的技术问题是针对现有技术而提供一种安全、有效地利用离子液体提取雷公藤内酯酮的方法。
本发明解决上述技术问题所采用的技术方案为:利用离子液体高效提取雷公藤内酯酮的方法,其特征在于包括以下步骤:
1)超声强化提取:含雷公藤内酯酮的植物原料经干燥粉碎后过40~80目筛,按固液比1:5~50加入体积比为10:0.1~0.8:2~10的乙醇、水和咪唑类离子液体Ⅰ混合液,于超声功率密度10~200W/cm
2)有机溶剂萃取:将脂肪族羧酸酯和一定量的水加入到所述步骤1)得到的提取液中,按提取液、水与脂肪族羧酸酯的体积比1~5:1~3:1,萃取1~5次。分离有机相得雷公藤内酯酮萃取相,然后将有机相在40~60℃下减压浓缩至近干,得到含有雷公藤内酯酮的浸膏。萃取余液可循环使用,该萃取余液的主要成份为上述咪唑类离子液体Ⅰ;
3)柱层析净化:将得到的含有雷公藤内酯酮的浸膏与硅胶(200~300目)按重量比1:10~100进行充分混合后装入一支底部具有筛板的玻璃层析柱中,先用适量乙醚淋洗,再用体积比为4:1的乙醚与乙酸乙酯混合溶剂洗脱,控制洗脱液流速不大于10mL/min,收集洗脱液,然后将其在40~60℃下减压浓缩至近干,得到雷公藤内酯酮粗品;
4)HSCCC分离纯化:选择HSCCC溶剂体系,按体积/重量比0.2~2:1(mL/mg)将HSCCC溶剂体系和上述雷公藤内酯酮的粗品加入到分液漏斗中,震荡、静置分层、平衡后,将上、下相分开,以溶剂体系的上相为固定相,溶剂体系的下相为流动相,调整转速,以一定流速泵入流动相,根据检测器显示的谱图分步收集目标物,获得含雷公藤内酯酮的溶液;
5)真空冷冻干燥:在适当温度、压力下,将上述雷公藤内酯酮溶液进行真空冷冻干燥,并回收有机萃取剂,得到纯度大于95%的雷公藤内酯酮。
作为优选,所述咪唑类离子液体Ⅰ为1-烯丙基-3-甲基咪唑氯盐、1-乙基-3-甲基咪唑溴盐、1-乙基-3-甲基咪唑氯盐、1-辛基-3-甲基咪唑氯盐、1-丁基-3-甲基咪唑溴盐中的至少一种。
作为优选,所述步骤1)中乙醇、水和咪唑类离子液体Ⅰ混合液的体积比为10:0.5:5。
作为优选,所述HSCCC溶剂体系为体积比为2:3:3:1∶0.05的正己烷-醋酸乙酯-甲醇-水-离子液体Ⅱ配制的HSCCC溶剂体系、体积比为2:3:3:2∶0.05的甲基叔丁基醚-正丁醇-乙醇-水-离子液体Ⅱ配制的HSCCC溶剂体系或者体积比为1:2:2:2∶0.05正己烷-醋酸乙酯-乙醇-水-离子液体Ⅱ配制的HSCCC溶剂体系中的任意一种。
作为优选,所述咪唑类离子液体Ⅱ为1-烯丙基-3-甲基咪唑溴盐、1-乙基-3-甲基咪唑六氟磷酸盐、1-乙基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑四氟硼酸盐中的至少一种。
与现有技术相比,本发明的优点在于:采用了按一定比例混合而成的乙醇、水和咪唑类离子液体Ⅰ混合溶液作为提取液,同时结合超声辅助技术在含有雷公藤内酯酮的植物原料中提取雷公藤内酯酮,该提取液与纯有机溶剂提取液相比,大大节约了有机溶剂的使用量,绿色、环保、经济,降低了挥发性有机溶剂对环境及实验人员带来的污染和危害,同时由于添加了离子液体,大大改善了提取效果,提高了提取效率。进一步,本发明在HSCCC流动相中添加了功能化离子液体,明显缩短了HSCCC的分离时间,显著提高了分离效率,得到的雷公藤内酯酮的纯度大于95%,而且在环境友好性和人体安全性方面更具优势。
附图说明
图1为本发明实施例1中的HSCCC的雷公藤内酯酮的紫外色谱图,
图2为雷公藤内酯酮的化学结构式图。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
实施例1:
1)超声强化提取:取雷公藤根1.0kg,干燥粉碎后过60目筛,然后取100g粉末于放入2500毫升锥形瓶中,按固液比1:10(W/V)加入乙醇/水/1-乙基-3-甲基咪唑氯盐(10:0.5:8,V/V/V)的混合物,于超声功率密度100W/cm
2)有机溶剂萃取:将乙酸乙酯和一定量的水加入到上述步骤1)得到的提取液中,按提取液、水与乙酸乙酯的体积比3:2:1萃取3次,分离有机相得雷公藤内酯酮萃取相,然后将得到的有机萃取相在55℃下减压浓缩至近干,得到含有雷公藤内酯酮的浸膏。萃取余液循环使用,该萃取余液的主要成分为离子液体Ⅰ(1-乙基-3-甲基咪唑氯盐)。
3)柱层析净化:将得到的含有雷公藤内酯酮的浸膏1g与50g硅胶(200~300目)充分混合后装入一支底端带有筛板的玻璃层析柱中,先用100mL乙醚淋洗,再用体积比为4:1的乙醚与乙酸乙酯混合溶剂150mL洗脱,控制洗脱液的流速不大于10mL/min,收集洗脱液,然后将得到的洗脱液在55℃下减压浓缩至近干,得到雷公藤内酯酮粗品;
4)HSCCC分离纯化:称取步骤3)得到的雷公藤内酯酮粗品500mg,选择正己烷-醋酸乙酯-乙醇-水-1-烯丙基-3-甲基咪唑溴盐(2:3:3:1∶0.05,V/V)作为HSCCC溶剂体系,将250mL的HSCCC溶剂体系以及上述雷公藤内酯酮粗品加入分液漏斗中,震荡使溶液充分混合,放置过夜,分相平衡后分出上相和下相。以溶剂体系的上相为固定相,下相为流动相,调整转速为800r/min,柱温为30℃,用高速逆流色谱仪(上海同田生物技术有限公司生产的TBE-1000A型)以5.0mL/min流速泵入HSCCC螺旋管,根据检测器显示的谱图收集目标物,获得雷公藤内酯酮的溶液。
5)真空冷冻干燥:将步骤4)得到的收集液,预冻温度-20℃,工作压力25Pa,升华温度50℃,解析温度70℃,得到纯度大于95%的雷公藤内酯酮。
检测采用Agilent 1100series高效液相色谱仪,色谱柱为Zorbax XDB-C18柱(150mm×4.6mm I.D.,5μm,Agilent Technologies,USA),流动相为0.05%醋酸-醋酸铵(5mmol/L)溶液/甲醇(35:65,V/V),流速为0.8mL/min,柱温为35℃,紫外检测器在220nm波长下进行检测,雷公藤内酯酮的纯度大于95%。
实施例2:
1)超声强化提取:取雷公藤茎1.0kg,干燥粉碎后过60目筛,然后取100g粉末放入2500毫升锥形瓶中,按固液比1:25(W/V)加入乙醇/水/1-乙基-3-甲基咪唑溴盐(10:0.2:6,V/V/V)的混合物,于超声功率密度50W/cm
2)有机溶剂萃取:将乙酸丁酯和一定量的水加入到上述步骤1)得到的提取液中,提取液、水与乙酸丁酯的体积比为4:2:1,萃取3次,分离有机相得雷公藤内酯酮萃取相,然后将得到的有机萃取相在55℃下减压浓缩至近干,得到含有雷公藤内酯酮的浸膏。萃取余液循环使用,该萃取余液即1-乙基-3-甲基咪唑溴盐。
3)柱层析净化:将得到的含有雷公藤内酯酮的浸膏1g与50g硅胶(200~300目)充分混合后装入一支底端带有筛板的玻璃层析柱中,先用50mL乙醚淋洗,再用体积比为4:1的乙醚与乙酸乙酯混合溶剂150mL洗脱,控制洗脱液的流速不大于10mL/min,收集洗脱液,然后将得到的洗脱液在45℃下减压浓缩至近干,得到雷公藤内酯酮粗品;
4)HSCCC分离纯化:称取步骤3)得到的雷公藤内酯酮粗品500mg,选择甲基叔丁基醚-正丁醇-乙腈-水-1-乙基-3-甲基咪唑六氟磷酸盐(2:3:3:2∶0.05,v/v)作为HSCCC溶剂体系,将250mL的HSCCC溶剂体系以及上述雷公藤内酯酮粗品加入分液漏斗中,震荡使溶液充分混合,放置过夜,分相平衡后分出上相和下相。以溶剂体系的上相为固定相,下相为流动相,调整转速为750r/min,柱温为30℃,用高速逆流色谱仪(上海同田生物技术有限公司生产的TBE-1000A型)以5.0mL/min流速泵入HSCCC螺旋管,根据检测器显示的谱图收集目标物,获得雷公藤内酯酮的溶液。
5)真空冷冻干燥:将步骤4)得到的收集液,预冻温度-15℃,工作压力30Pa,升华温度50℃,解析温度60℃,得到纯度大于95%的雷公藤内酯酮。
检测采用Agilent 1100series高效液相色谱仪,色谱柱为Zorbax XDB-C18柱(150mm×4.6mm I.D.,5μm,Agilent Technologies,USA),流动相为0.05%醋酸-醋酸铵(5mmol/L)溶液/甲醇(35:65,V/V),流速为0.8mL/min,柱温为35℃,紫外检测器在220nm波长下进行检测,雷公藤内酯酮的纯度大于95%。
实施例3:
1)超声强化提取:取雷公藤根1.0kg,干燥粉碎后过60目筛,然后取100g粉末放入2500毫升锥形瓶中,按固液比1:20(W/V)加入乙醇/水/1-丁基-3-甲基咪唑溴盐(10:0.7:9,V/V/V)的混合物,于超声功率密度50W/cm
2)有机溶剂萃取:将乙酸乙酯和一定量的水加入到上述步骤1)得到的提取液中,提取液、水与乙酸乙酯的体积比为2:2:1,萃取3次,分离有机相得雷公藤内酯酮萃取相,然后将得到的有机萃取相在45℃下减压浓缩至近干,得到含有雷公藤内酯酮的浸膏。萃取余液循环使用,该萃取余液的主要成分为1-丁基-3-甲基咪唑溴盐。
3)柱层析净化:将得到的含有雷公藤内酯酮的浸膏1g与50g硅胶(200~300目)充分混合后装入一支底端带有筛板的玻璃层析柱中,先用50mL乙醚淋洗,再用体积比为4:1的乙醚与乙酸乙酯混合溶剂200mL洗脱,控制洗脱液的流速不大于10mL/min,收集洗脱液,然后将得到的洗脱液在45℃下减压浓缩至近干,得到雷公藤内酯酮粗品;
4)HSCCC分离纯化:称取步骤3)得到的雷公藤内酯酮粗品500mg,选择甲基叔丁基醚-正丁醇-乙醇-水-1-丁基-3-甲基咪唑四氟硼酸盐(2:3:3:2∶0.05,v/v)作为HSCCC溶剂体系,将250mL的HSCCC溶剂体系以及上述雷公藤内酯酮粗品加入分液漏斗中,震荡使溶液充分混合,放置过夜,分相平衡后分出上相和下相。以溶剂体系的上相为固定相,下相为流动相,调整转速为750r/min,柱温为30℃,用高速逆流色谱仪(上海同田生物技术有限公司生产的TBE-1000A型)以5.0mL/min流速泵入HSCCC螺旋管,根据检测器的谱图收集目标物,获得雷公藤内酯酮的溶液。
5)真空冷冻干燥:将步骤4)得到的收集液,预冻温度-15℃,工作压力30Pa,升华温度50℃,解析温度60℃,得到纯度大于95%的雷公藤内酯酮。
检测采用Agilent 1100series高效液相色谱仪,色谱柱为Zorbax XDB-C18柱(150mm×4.6mm I.D.,5μm,Agilent Technologies,USA),流动相为0.05%醋酸-醋酸铵(5mmol/L)溶液/甲醇(35:65,V/V),流速为0.8mL/min,柱温为35℃,紫外检测器在220nm波长下进行检测,雷公藤内酯酮的纯度大于95%。
实施例4:
1)超声强化提取:取雷公藤叶1.0kg,干燥粉碎后过60目筛,然后取100g粉末放入2500毫升锥形瓶中,按固液比1:30(W/V)加入乙醇/水/1-辛基-3-甲基咪唑氯盐(10:0.4:7,V/V/V)的混合物,于超声功率密度20W/cm
2)有机溶剂萃取:将乙酸乙酯和一定量的水加入到上述步骤1)得到的提取液中,提取液、水与乙酸乙酯的体积比为2:1.5:1,萃取3次,分离有机相得雷公藤内酯酮萃取相,然后将得到的有机萃取相在45℃下减压浓缩至近干,得到含有雷公藤内酯酮的浸膏。萃取余液循环使用,该萃取余液的主要成分为1-辛基-3-甲基咪唑氯盐。
3)柱层析净化:将得到的含有雷公藤内酯酮的浸膏1g与50g硅胶(200~300目)充分混合后装入一支底端带有筛板的玻璃层析柱中,先用100mL乙醚淋洗,再用体积比为4:1的乙醚与乙酸乙酯混合溶剂150mL洗脱,控制洗脱液的流速不大于10mL/min,收集洗脱液,然后将得到的洗脱液在45℃下减压浓缩至近干,得到雷公藤内酯酮粗品;
4)HSCCC分离纯化:称取步骤3)得到的雷公藤内酯酮粗品500mg,选择正己烷-醋酸乙酯-乙醇-水-1-乙基-3-甲基咪唑六氟硼酸盐(1:2:2:2∶0.05,v/v)作为HSCCC溶剂体系,将250mL的HSCCC溶剂体系以及上述雷公藤内酯酮粗品加入分液漏斗中,震荡使溶液充分混合,放置过夜,分相平衡后分出上相和下相。以溶剂体系的上相为固定相,下相为流动相,调整转速为750r/min,柱温为30℃,用高速逆流色谱仪(上海同田生物技术有限公司生产的TBE-1000A型)以5.0mL/min流速泵入HSCCC螺旋管,根据检测器的谱图收集目标物,获得雷公藤内酯酮的溶液。
5)真空冷冻干燥:将步骤4)得到的收集液,预冻温度-15℃,工作压力25Pa,升华温度50℃,解析温度50℃,得到纯度大于95%的雷公藤内酯酮。
检测采用Agilent 1100series高效液相色谱仪,色谱柱为Zorbax XDB-C18柱(150mm×4.6mm I.D.,5μm,Agilent Technologies,USA),流动相为0.05%醋酸-醋酸铵(5mmol/L)溶液/甲醇(35:65,V/V),流速为0.8mL/min,柱温为35℃,紫外检测器在220nm波长下进行检测,雷公藤内酯酮的纯度大于95%。
实施例5:
1)超声强化提取:取雷公藤茎1.0kg,干燥粉碎后过60目筛,然后取100g粉末放入2500毫升锥形瓶中,按固液比1:25(W/V)加入乙醇/水/1-烯丙基-3-甲基咪唑氯盐(10:0.3:6,V/V/V)的混合物,于超声功率密度100W/cm
2)有机溶剂萃取:将乙酸丙酯和一定量的水加入到上述步骤1)得到的提取液中,提取液、水与乙酸丙酯的体积比为1:2:1,萃取3次,分离有机相得雷公藤内酯酮萃取相,然后将得到的有机萃取相在45℃下减压浓缩至近干,得到含有雷公藤内酯酮的浸膏。萃取余液循环使用,该萃取余液的主要成分为1-烯丙基-3-甲基咪唑氯盐。
3)柱层析净化:将得到的含有雷公藤内酯酮的浸膏1g与50g硅胶(200~300目)充分混合后装入一支底端带有筛板的玻璃层析柱中,先用100mL乙醚淋洗,再用体积比为4:1的乙醚与乙酸乙酯混合溶剂100mL洗脱,控制洗脱液的流速不大于10mL/min,收集洗脱液,然后将得到的洗脱液在45℃下减压浓缩至近干,得到雷公藤内酯酮粗品;
4)HSCCC分离纯化:称取步骤3)得到的雷公藤内酯酮粗品500mg,选择正己烷-醋酸乙酯-乙醇-水-1-烯丙基-3-甲基咪唑氯盐(1:2:2:2∶0.05,v/v)作为HSCCC溶剂体系,将250mL的HSCCC溶剂体系以及上述雷公藤内酯酮粗品加入分液漏斗中,震荡使溶液充分混合,放置过夜,分相平衡后分出上相和下相。以溶剂体系的上相为固定相,下相为流动相,调整转速为750r/min,柱温为30℃,用高速逆流色谱仪(上海同田生物技术有限公司生产的TBE-1000A型)以5.0mL/min流速泵入HSCCC螺旋管,根据检测器显示的谱图收集目标物,获得雷公藤内酯酮的溶液。
5)真空冷冻干燥:将步骤4)得到的收集液,预冻温度-20℃,工作压力25Pa,升华温度55℃,解析温度65℃,得到纯度大于95%的雷公藤内酯酮。
检测采用Agilent 1100series高效液相色谱仪,色谱柱为Zorbax XDB-C18柱(150mm×4.6mm I.D.,5μm,Agilent Technologies,USA),流动相为0.05%醋酸-醋酸铵(5mmol/L)溶液/甲醇(35:65,V/V),流速为0.8mL/min,柱温为35℃,紫外检测器在220nm波长下进行检测,雷公藤内酯酮的纯度大于95%。
实施例6:
1)超声强化提取:取雷公藤根1.0kg,干燥粉碎后过80目筛,然后取100g粉末放入2500毫升锥形瓶中,按固液比1:50(W/V)加入乙醇/水/1-丁基-3-甲基咪唑溴盐(10:0.4:7,V/V/V)的混合物,于超声功率密度80W/cm
2)有机溶剂萃取:将乙酸乙酯和一定量的水加入到上述步骤1)得到的提取液中,提取液、水与乙酸乙酯的体积比为3:4:3,萃取3次,分离有机相得雷公藤内酯酮萃取相,然后将得到的有机萃取相在45℃下减压浓缩至近干,得到含有雷公藤内酯酮的浸膏。萃取余液循环使用,该萃取余液的主要成分为1-丁基-3-甲基咪唑溴盐。
3)柱层析净化:将得到的含有雷公藤内酯酮的浸膏1g与50g硅胶(200~300目)充分混合后装入一支底端带有筛板的玻璃层析柱中,先用100mL乙醚淋洗,再用体积比为4:1的乙醚与乙酸乙酯混合溶剂100mL洗脱,控制洗脱液的流速不大于10mL/min,收集洗脱液,然后将得到的洗脱液在45℃下减压浓缩至近干,得到雷公藤内酯酮粗品;
4)HSCCC分离纯化:称取步骤3)得到的雷公藤内酯酮粗品500mg,选择正己烷-醋酸乙酯-甲醇-水-1-烯丙基-3-甲基咪唑氯盐(2:3:3:1∶0.05,v/v)作为HSCCC溶剂体系,将200mL的HSCCC溶剂体系以及上述雷公藤内酯酮粗品加入分液漏斗中,震荡使溶液充分混合,放置过夜,分相平衡后分出上相和下相。以溶剂体系的上相为固定相,下相为流动相,调整转速为750r/min,柱温为30℃,用高速逆流色谱仪(上海同田生物技术有限公司生产的TBE-1000A型)以5.0mL/min流速泵入HSCCC螺旋管,根据检测器的谱图收集目标物,获得雷公藤内酯酮的溶液。
5)真空冷冻干燥:将步骤4)得到的收集液,预冻温度-20℃,工作压力25Pa,升华温度55℃,解析温度65℃,得到纯度大于95%的雷公藤内酯酮。
检测采用Agilent 1100series高效液相色谱仪,色谱柱为Zorbax XDB-C18柱(150mm×4.6mm I.D.,5μm,Agilent Technologies,USA),流动相为0.05%醋酸-醋酸铵(5mmol/L)溶液/甲醇(35:65,V/V),流速为0.8mL/min,柱温为35℃,紫外检测器在220nm波长下进行检测,雷公藤内酯酮的纯度大于95%。
利用离子液体超声提取雷公藤内酯酮的方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0