专利摘要
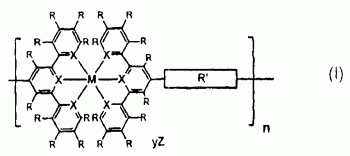
获得了基于三联吡啶基单体和过渡金属的高度荧光金属-超分子。这些稳健的超分子提供了从紫罗兰色到蓝色、绿色或黄色发射的高量子产率。由于具有令人合意的诸如高亮度、高纯度、低成本和高热稳定性的特性,这些超分子显现出有前景的用于聚合发光二极管(PLEDs)的发射器。该超分子的分子结构如式I表示:(I)其中M代表IB、IIB、VIIA、VIIIA族或镧系金属;R在每次出现时各自独立并选自氢、卤素、烷基、被取代的烷基、芳基、被取代的芳基或公知的供体和受体基团;X在每次出现各自独立并为氮或碳原子;R’选自烷氧基、芳氧基、杂芳氧基、烷基、芳基、杂芳基、烷基酮、芳基酮、杂芳基酮、烷基酯、芳基酯、杂芳基酯、烷基酰胺、芳基酰胺、杂芳基酰胺、烷硫基、芳硫基、氟代烷基、氟代芳基、胺、酰亚胺、羧酸酯、磺酰基、亚烷基氧基、聚亚烷基氧基、或其组合。n为1到100,000整数;Z为相反离子并选自乙酸根、乙酰丙酮酸根、环己烷丁酸根、乙基己酸根、卤离子、六氟磷酸根、六氟乙酰丙酮酸根、硝酸根、高氯酸根、磷酸根、硫酸根、四氟硼酸根或氟代甲磺酸根;y为0-4的整数。
权利要求
1、一种超分子,所述超分子包括至少一个选自下列的重复结构单元
2、根据权利要求1的超分子,其中M代表IB、IIB、VIIA、VIIIA族或镧系金属。
3、根据权利要求1的超分子,其中R在每次出现时各自独立并选自氢、卤素、烷基、被取代的烷基、芳基、被取代的芳基以及公知的供体和受体基团。
4、根据权利要求1的超分子,其中X在每次出现时各自独立并为氮或碳原子。
5、根据权利要求1的超分子,其中R’选自烷氧基、芳氧基、杂芳氧基、烷基、芳基、杂芳基、烷基酮、芳基酮、杂芳基酮、烷基酯、芳基酯、杂芳基酯、烷基酰胺、芳基酰胺、杂芳基酰胺、烷硫基、芳硫基、氟代烷基、氟代芳基、胺、酰亚胺、羧酸酯、磺酰基、亚烷基氧基、聚亚烷基氧基、或其组合。
6、根据权利要求1的超分子,其中n为1到100,000的整数。
7、根据权利要求1的超分子,其中Z为相反离子并选自乙酸根、乙酰丙酮酸根、环己烷丁酸根、乙基己酸根、卤离子、六氟磷酸根、六氟乙酰丙酮酸根、硝酸根、高氯酸根、磷酸根、硫酸根、四氟硼酸根或氟代甲磺酸根。
8、根据权利要求1的超分子,其中y为0-4的整数。
9、根据权利要求2的超分子,其中所述的M为IIB族过渡金属(包括Zn金属)。
10、根据权利要求3的超分子,其中所述的R为质子。
11、根据权利要求4的超分子,其中所述的X为氮原子。
12、根据权利要求7的超分子,其中所述的Z为六氟膦酸根离子(PF6-)。
13、根据权利要求9到12任一项的超分子,所述超分子被下式所表示:
其中R’选自:
14、一种聚合发光二极管(PLED),其包括:
(a)透明的空穴注入阳极层;
(b)透明的空穴传输层;
(c)活性发射层;以及,
(d)电子-注入阴极层。
15、根据权利要求14的聚合发光二极管,其中所述的透明空穴传输层选自聚(苯胺)(PANI)或聚(3,4-亚乙二氧基噻吩)/(聚(苯乙烯磺酸酯))(PEDOT/PSS)。
16、根据权利要求14的聚合发光二极管,其中所述的透明的空穴注入阳极层选自高功函金属或金属合金。
17、根据权利要求16的聚合发光二极管,其中所述的阳极选自金、银、铜、氟-锡-氧化物(FTO)以及铟-锡-氧化物(ITO)。
18、根据权利要求14的聚合发光二极管,其中所述的透明的电子-注入阴极层选自低功函金属或合金。
19、根据权利要求18的聚合发光二极管,其中所述的阴极选自钙、镁、锂、钠、铝、银或它们的合金。
20、根据权利要求14的聚合发光二极管,其中所述的发射层选自携带至少一个基于三联吡啶基团和过渡金属的超分子。
21、根据权利要求20的聚合发光二极管,其中所述的超分子具有下式的组成:
22、根据权利要求21的超分子,其中M代表IB、IIB、VIIA、VIIIA族或镧系金属。
23、根据权利要求21的超分子,其中R在每次出现时各自独立并选自氢、卤素、烷基、被取代的烷基、芳基、被取代的芳基以及公知的供体和受体基团。
24、根据权利要求21的超分子,其中在每次出现时X各自独立并为氮或碳原子。
25、根据权利要求21的超分子,其中R’选自烷氧基、芳氧基、杂芳氧基、烷基、芳基、杂芳基、烷基酮、芳基酮、杂芳基酮、烷基酯、芳基酯、杂芳基酯、烷基酰胺、芳基酰胺、杂芳基酰胺、烷硫基、芳硫基、氟代烷基、氟代芳基、胺、酰亚胺、羧酸酯、磺酰基、亚烷基氧基、聚亚烷基氧基、或其组合。
26、根据权利要求21的超分子,其中n为1到100,000的整数。
27、根据权利要求21的超分子,其中Z为相反离子并选自乙酸根、乙酰丙酮酸根、环己烷丁酸根、乙基己酸根、卤离子、六氟磷酸根、六氟乙酰丙酮酸根、硝酸根、高氯酸根、磷酸根、硫酸根、四氟硼酸酯或氟代甲磺酸根。
28、根据权利要求21的超分子,其中y为0-4的整数。
29、一种制备根据权利要求1到13和20到28任一项的超分子的方法,其包括加热下式化合物的混合物:
和M
其中,M代表IB、IIB、VIIA、VIIIA族或镧系金属;R在每次出现时各自独立并选自氢、卤素、烷基、被取代的烷基、芳基、被取代的芳基或公知的供体和受体基团;X在每次出现时各自独立并为氮或碳原子;R’选自烷氧基、芳氧基、杂芳氧基、烷基、芳基、杂芳基、烷基酮、芳基酮、杂芳基酮、烷基酯、芳基酯、杂芳基酯、烷基酰胺、芳基酰胺、杂芳基酰胺、烷硫基、芳硫基、氟代烷基、氟代芳基、胺、酰亚胺、羧酸酯、磺酰基、亚烷基氧基、聚亚烷基氧基、或其组合。
说明书
技术领域发明领域
本发明涉及高度荧光的金属-超分子,通过超分子的基团的改变,其显示出强而不同的色彩发射,对设计有效的电致发光光发射聚合物和设备,提供了新的前景。
技术背景背景技术
以有机和聚合光-发射设备(OLEDs和PLEDs)为特征的产品,在1999和2002年首次进入市场。因比LCD技术具有许多优点,如简单的结构、薄-层厚、轻-重量、宽的视角、低的运行电压、以及生产大面积显示器的可能性,其深受欢迎,超过100家制造商致力于OLED和PLED的发展。
已用包括小分子和聚合物在内的有机材料来制作该装置。小分子的开发商包括Eastman Kodak公司、Inemitsu Kosan有限公司、索尼化学公司、以及Universal Display公司(UDC)。聚合物的开发商包括Cambridge Display Technology(CDT)、Dow化学公司、以及Covion有机半导体GmbH。
有机聚合物要比小分子具有显著的加工优点,尤其对于大面积显示器。通过使用旋转包衣或喷墨打印技术,很容易制造该设备。然而,蓝光PLEDs显示一些技术问题。这些包括设计缺陷、纯化聚合物困难、色彩纯度问题、低效率(最大效率~2.5cd/A)以及设备的短寿命(在20mA/cm2时~200小时(一半亮度的寿命))。
在用作PLEDs发射层有前途的材料当中,已经披露了聚(亚苯基亚乙烯基)(PPV)(US5,747,182)和PPV衍生物,如聚(2-甲氧基-5-(2’-乙基乙氧基-1,4-亚苯基亚乙烯基)(MEH-PPV)(US5,401,827;US6,284,435)。其他合适的材料包括聚(对亚苯基)(PPP)和相关衍生物(Angew.Chem.Int.Ed.,37,402,(1998);Adv.Mater.,11,895,(1999)),聚噻吩和相关衍生物(Macromolecules,28,7525,(1995)),聚喹啉及其相关衍生物(Macromolecules,35,382,(2002);Macromolecules,34,7315,(2001)),以及聚芴(PFO)及其相关衍生物(WO01/62822A1;US6,169,163;Macromolecules,35,6094,(2002))。通常,基于PPV的材料表现出有高PL和EL效率,以及色彩转换性能。然而,由于光氧化降解,它们的EL设备的长期稳定性被阻碍。聚(对亚苯基)是相对不溶和不熔的。聚噻吩和相关衍生物已被显示转变为从篮到近红外的电致发光,但量子效率通常低。聚芴具有液晶性能,其导致设备性能快速下降。
因此,需要开发一种稳固的聚合物系,其能提供有效光发射聚合物设计的新前景,以及可被用作电致发光设备中高性能发射材料或主材料。
近些年来,2,2’:6’,2”-三联吡啶(terpy)作为金属离子强的螯合剂而获得相当大的注意。尤其与过渡金属,这些金属-三元聚合物由于它们氧化还原特性和光学物理性能,已引起人们强烈的兴趣。
Rehaln等报道通过三氯化钌(II)与基于三联吡啶单体之间的反应形成的杆样钌(II)配位聚合物。高分子量聚合物固有的粘性为300mLg-1数量级。Chan和同事已经合成并鉴定了聚(对亚苯基亚乙烯基)和在其主链中含双(2,2’:6’,2”-三联吡啶)钌(II)络合物的聚酰亚胺以及混有侧挂的三联吡啶钌络合物的聚(亚苯基亚乙烯基)络合物(Appl.Phys.Lett.,71,2919,(1997);Chem.Mater.,11,1165,(1999);Adv.Mater.,11,455,(1999))。乙烯基取代的2,2’:6’,2”-三联吡啶和双官能钌(II)-三联吡啶络合物聚合物已被制得(Macromol.Rapid Commun.,23,411,(2002))。
基于三联吡啶的树状聚合物的设计和合成已是另一吸引人的领域。具有外侧三联吡啶单元的聚(酰氨基胺)树状聚合物及其铁(II)络合物已被报道(Macromol.Rapid Commun.,20,98,(1999))。Abruna等(J.Phys.Chem.B,105,8746,(2001))制得侧挂三联吡啶的聚(酰氨基胺)和含带有Fe2+或Co2+离子的配体的双(三联吡啶)。Constable等(Chem.Commun.,1073,(1997))已披露了一些金属茂树状聚合物和金属树状聚合物。
此外,Khan等报道了在其主链中含三联吡啶连接基团的铂(II)聚炔烃(J.Chem.Soc.Dalton Trans.,1358,(2002))。这些聚合材料表现出随着其骨架中吡啶单元数量的增加其稳定性降低。Schubert等(Macromol.Rapid Commun.,22,1358,(2001))制得用三联吡啶基团末端封合的旋光性聚(L-丙交酯)。在相转移条件下,合成了铁(II)为中心的聚(L-丙交酯)。同样,Schubert和同事制得了包含具有聚(氧乙烯)和聚(氧四亚甲基)的三联吡啶片断的共聚物的锌和钴金属。然而,仅报道UV-vis、GPC和NMR研究。Wurthner等(Chem.Commun.,1878,(2002))完成了含双(三联吡啶)基团的基于苝双酰亚胺的聚合物。
本发明中,通过锌离子和基于三联吡啶的单体之间的简单反应制备了金属-诱导和自-装配体系的聚合物。金属络合物的八等面体导致沿着聚合物链形成牢固的连接。这些具有很好限制的建筑结构的金属超分子,高量子效率地产生从紫罗兰色至蓝色、绿色、或黄色的强烈发射。
发明内容发明概述
本发明的主要目的是制备金属超分子体系及其在例如电致发光(EL)设备中的用途。
在一实施方案中,本发明涉及一种用作三齿配体并通过螯合多种过渡金属形成稳定络合物的分子。
在一实施方案中,本发明涉及一种包含选自基于三联吡啶的基团的重复单元的聚合物组合物,以及其合成方法和用途,如在聚合发光二极管(PLEDs)中的用途。
在一实施方案中,金属超分子由基于三联吡啶的单体和过渡金属组成。
根据本发明,制得一类新的金属超分子。其中该金属超分子的优选实施方案为:
其中,M代表IB、IIB、VIIA、VIIIA族或镧系金属;R在每次出现时各自独立并选自氢、卤素、烷基、被取代的烷基、芳基、被取代的芳基、或公知的供体和受体基团;X在每次出现时各自独立并为氮或碳原子;R’选自烷氧基、芳氧基、杂芳氧基、烷基、芳基、杂芳基、烷基酮、芳基酮、杂芳基酮、烷基酯、芳基酯、杂芳基酯、烷基酰胶、芳基酰胶、杂芳基酰胶、烷硫基、芳硫基、氟代烷基、氟代芳基、胺、酰亚胺、羧酸酯、磺酰基、亚烷基氧基、聚亚烷基氧基、或其组合;n为1到100,000整数;Z为相反离子并选自乙酸根、乙酰丙酮酸根、环己烷丁酸根、乙基己酸根、卤离子、六氟磷酸根、六氟乙酰丙酮酸根、硝酸根、高氯酸根、磷酸根、硫酸根、四氟硼酸根或氟代甲磺酸根;y为0-4的整数。
尤其是,一方面,本发明通过在N-甲基吡咯烷酮(NMP)中锌离子与基于三联吡啶的单体之间的反应可以容易地制得本发明的超分子。
其中R’为
在另一下实施方案中,该超分子的每个重复单元在空间上以被良好控制的线形排列的方式部署。在一个实施方案中,通过变换不同的R’或超分子的R’上的取代基,反射波长从紫罗兰色到蓝色、绿色或黄色的范围变化,并依赖于聚合物的组成。
本发明的具体实施方案涉及聚合发光二极管(PLEDs),其包括:
(a)透明的空穴注入阳极层
(b)透明的空穴传输层
(c)包含超分子的活性发射层以及
(d)电子-注入阴极层
其中,透明的空穴注入阳极层选自高功函金属或金属合金;透明空穴传输层选自聚(苯胺)(PANI)或聚(3,4-亚乙二氧基噻吩)/(聚(苯乙烯磺酸酯))(PEDOT/PSS);活性发射层选自本发明所披露的金属-超分子;以及电子-注入阴极层选自低功函的金属。
附图说明附图的简要说明
图1,基于三联吡啶单体6a-6e的结构
图2,基于三联吡啶单体6f-6i的结构
图3,基于三联吡啶聚合物7a-7d的结构
图4,基于三联吡啶聚合物7e-7i的结构
图5,模型化合物5a和5b的结构
图6,模型化合物5a和聚合物7a和7b的TGA差示热分析图
图7,聚合物7a的UV-vis和PL光谱
图8,在DMAC中的以及作为旋转-涂布和浇铸薄膜的聚合物7c的发射光谱
图9,作为旋转-涂布薄膜的聚合物7a、7f、7g和7i的发射光谱
图10,在DMAC中的以及作为旋转-涂布和浇铸薄膜的聚合物7h的发射光谱
图11,金属-超分子的能量示意图
图12,本发明PLED的示意图
图13,设备A的电致发光谱
图14,设备A的电流密度-电压-亮度曲线
图15,设备B的电致发光谱
图16,设备B的电流密度-电压-亮度曲线
表1,聚合物7a~7i以及模型化合物5a和5b的物理特性
表2,在DMAC中的和用作薄膜的聚合物7a~7i以及在DMAC中的模型化合物5a和5b光学物理特性
表3,超分子和模型化合物的HOMO-LUMO能级和带隙
具体实施方式发明的详细说明
本发明总体上涉及超分子的合成、光谱特征、光致发光、电致发光以及它们在聚合发光二极管(PLEDs)中的应用。在本发明中,设计了两组超分子。在一组中,间隔基团单元R’基于沿着超分子的主链的柔性氧亚甲基连接基团(-OCH2-)。在第二组中,该间隔基团单元基于沿着超分子的刚性骨架的共轭亚苯基衍生物。
提供实施例以助于发明的理解,而不是并且也不应当认为是对接下来的权利要求所提出的本发明范围的限制。
所给出的实施例阐明了模型化合物5a和5b、单体6a、6f和6i、以及聚合物7h的合成方法。模型化合物5a和5b是根据文献(Polyhedron,17,373,(1998))所披露的改良方法而被合成的。通过在N-甲基吡咯烷酮(NMP)中醋酸锌二水合物和基于三联吡啶的单体之间的简单反应,锌金属离子被当作了装配中心而形成聚合物7a-7i。
实施例1
模型化合物5a的合成-在10ml N-甲基吡咯烷酮(NMP)中,在氮气氛中,在100℃下加热醋酸锌二水合物(1mmol)和4’-苯基-2,2’:6’,2”-三联吡啶(1mmol)3小时。过滤后,向滤液中加入过量的六氟磷酸钾(KPF6)。用甲醇洗涤沉淀,固体用乙醇和CH3CN的混合物重结晶。产率:86%。FABMS:m/e 685;C42H30N6Zn的计算m/e 684.1。
1H NMR (DMSO,δ,ppm):9.38(1H,s),9.12(4H,d,J=8.0Hz),8.41(4H,d,J=7.1Hz),8.27(4H,t,J=7.5Hz),7.94(4H,d,J=4.2Hz),7.5(6H,m),748(4H,t,J=6.1Hz).13C NMR(DMSO,δ,ppm):155.1,149.4,147.7,141.2,135.7,131.1,129.8,129.4,128.1,127.6,123.5,121.1.
实施例2
模型化合物5b的合成-产率:80%。FABMS:m/e 885;C54H54N6O2Zn的计算m/e 884.4。
1H NMR(CDCl3,δ,ppm):9.33(4H,s),914(4H,d,J=8.0Hz),8.44(4H,d,J=8.5Hz),8.27(4H,t,J=7.6Hz),7.93(4H,d,J=4.7Hz),7.48(4H,dd,J=12.6Hz,J=5.6Hz),7.29(4H,d,J=8.7Hz),4.17(4H,t,J=6.6Hz),1.81(8H,m),1.48(4H,m),0.92(6H,t,J=6.8Hz).13C NMR(CDCl3,δ,ppm):161.9,155.1,149.8,148.3,141.7,130.3,128.1,127.7,123.9,120.4,115.8,68.4,31.5,29.1,25.7,22.6,14.4.
实施例3
单体6a的合成-向100ml DMSO的KOH(2.5mmol)的悬浮液中加入4’-(4-羟基苯基)-2,2’:6’,2”-三联吡啶(2.05mmol)。在90℃下搅动1小时,加入1,8-二溴辛烷(1.0mmol)和KI(催化量)。所得的混合物搅动24小时。悬浮液冷却至室温并倒进500ml水中。过滤沉淀。所得的固体用乙醇和丙酮的混合物重结晶。产率:72%。FABMS:m/e761;C50H44N6O2的计算m/e 760.9。
1H NMR(CDCl3,δ,ppm):8.71(8H,m),8.66(6H,d,J=8.0Hz),7.86(8H,m),7.34(4H,dt,J=4.8Hz,J=1.0Hz),7.02(4H,d,J=8.8Hz),4.04(4H,t,J=6.5Hz),1.83(4H,m),1,50(8H,m).13C NMR(CDCl3,δ,ppm):156.4,155.8,149.8,149.1,136.8,130.5,128.5,123.7,121.3,118.2,118.1,114.9,68.1,29.3,29.2,26.3.
实施例4
单体6b的合成-产率:60%。FABMS:m/e 898;C58H40N8O3的计算m/e 897.0。
1H NMR(CDCl3,δ,ppm):872(8H,m),8.66(4H,d,J=8.0Hz),8.19(4H,d,J=8.3Hz),7.89(8H,m),7.65(4H,d,J=8.2Hz),7.34(4H,m),7.13(4H,d,J=1.9Hz),5.24(4H,s).13C NMR(CDCl3,δ,ppm):166.1,161.1,158.1,157.6,151.4,150.8,142.5,138.6,135.9,133.2,130.4,129.6,129.0,125.5,125.3,123.1,120.1,117.0,100.6,71.2.
实施例5
单体6c的合成-产率:58%。FABMS:m/e 753;C52H36N6O2的计算m/e 752.9。
1H NMR(CDCl3,δ,ppm):8.70(8H,m),8.65(4H,d,J=8.0Hz),7.87(8H,m),7.59(1H,s),7.46(3H,s),7.33(4H,m),712(4H,d,J=8.0Hz),5.18(4H,s).13C NMR(CDCl3,δ,ppm):156.4,155.8,149.1,136.8,131.1,129.0,128.6,127.1,126.5,123.7,121.3,118.3,115.3,69.9.
实施例6
单体6d的合成-产率:62%。FABMS:m/e 753;C52H36N6O2的计算m/e 752.9。
实施例7
单体6e的合成-产率:52%。FABMS:m/e 1094;C70H72N6O6的计算m/e 1093.4。
1H NMR(CDCl3,δ,ppm):8.75(4H,s),8.73(4H,d,J=4.7Hz),8.68(4H,d,J=8.0Hz),8.00(4H,d,J=8.6Hz),7.88(4H,dt,J=7.6Hz,J=1.7Hz),7.62(2H,s),7.38(8H,m),1.53(14H,m),1.22(24H,m).13C NMR(CDCl3,δ,ppm):156.1,152.4,149.2,136.9,128.5,123.8,122.2,121.4,118.8,70.1,31.9,29.6,29.3,26.0.
实施例8
单体6f的合成-在25ml的甲苯和25ml的1M碳酸钠水溶液的非均匀体系中,4’-(4-溴苯基)-2,2’:6’,2”-三联吡啶(2.05mmol)、2,5-二十二烷氧苯基-1,4-二硼酸(1mmol)以及[Pd(PPh3)2](1mol-%)回流24小时。搅动之后,加入100ml水,用氯仿(3×100ml)萃取所得的混合物。有机层用硫酸钠干燥并在真空下除去。固体用乙醇和氯仿的混合物重结晶。产率:80%。FABMS:m/e 1062;C72H80N6O2的计算m/e1061.4。
1H NMR(CDCl3,δ,ppm):8.83(4H,s),8.73(4H,m),8.69(4H,d,J=8.0Hz),8.01(4H,d,J=8.3Hz),7.90(4H,dt,J=7.7Hz,J=1.1Hz),7.79(4H,d,J=8.6Hz),7.36(4H,m),7.09(2H,s),1.72(4H,m),1.17(40H,m),0.83(6H,m).13C NMR(CDCl3,δ,ppm):156.4,156.0,150.5,150.0,149.2,139.3,136.8,130.1,116.9,123.8,121.4,118.8,116.3,69.9,31.9,297,29.6,29.4,29.3,26.1,22.7,14.1.
实施例9
单体6g的合成-产率:70%。FABMS:m/e 954;C66H44N6O2的计算m/e 953.1。
1H NMR(CDCl3,δ,ppm):8.83(4H,s),8.77(4H,dd,J=1.7Hz,J=0.9Hz),8.69(4H,m),8.00(4H,d,J=8.4Hz),7.90(4H,dt,J=7.7Hz,J=1.8Hz),7.77(4H,d,J=8.4Hz),7.35(4H,m),5.10(4H,s).13C NMR(CDCl3,δ,ppM):156.4,156.0,150.3,149.2,136.8,130.1,128.5,127.8,127.2,127.0,123.8,121.4,118.8,117.3,71.8.
实施例10
单体6h的合成-产率:73%。FABMS:m/e 1006;C71H68N6的计算m/e 1005.4。
1H NMR(DMSO,δ,ppm):8.83(4H,s),8.76(4H,m),8.68(4H,m),8.05(4H,m),7.90(4H,dt,J=7.8Hz,J=1.8Hz),7.83(6H,d,J=8.2Hz),7.70(4H,m),7.38(4H,m),2.11(4H,m),1.11(18H,m),0.80(8H,m).13C NMR(DMSO,δ,ppm):156.4,156.1,151.9,1498,149.2,142.4,140.4,139.4,137.2,136.9,127.7,127.7,126.1,123.8,121.5,121.4,120.2,118.7,55.4,40.4,31.8,30.0,29.2,23.9,22.6,14.0.
实施例11
单体6i的合成-在氮气氛中,向50ml烧瓶中加入二乙烯苯(1mmol)、4’-(4-溴苯基)-2,2’:6’,2”-三联吡啶(2mmol)、醋酸钯(II)(5mol-%)、以及三-邻甲苯基膦(0.4当量)。通过注射器加入无水DMF并且搅动溶液直至所有固体溶解。加入三正丁胺(1ml)并在100℃下搅动5天。将溶液倒入甲醇中。固体用乙醇和氯仿(8∶2;v/v)的混合物重结晶。产率:77%。FABMS:m/e 745;C52H36N6的计算m/e744.9。
实施例12
单体7h的合成-向单体6h(0.1mmol)的50ml N-甲基吡咯烷酮溶液中,在105℃下逐滴加入醋酸锌二水合物(0.1mmol)在5ml NMP中的溶液。在氮气氛中搅动24小时,向热溶液中加入过量六氟磷酸钾(KPF6)。将所得溶液倒入甲醇中,沉淀出固体。通过用DMAC和甲醇反复沉淀来进行纯化。得到的聚合物在80℃下真空干燥24小时,获得黄色固体。产率:80%。
a内在的密度用Ubbelohde粘度计在30±0.1℃下在NMP中测定
b纯化后的产率
c通过TGA以20℃/min加热速率测定分解温度
表1,聚合物7a~7b和模型化合物5a和5b的物理特性
表1概括了该超分子的物理特性。用Ubbelohde粘度计在30±0.1℃下在NMP中测得该超分子的内在密度在0.48-1.21dL/g范围之内。通过TGA和DSC测得该超分子的热性能。图6中描述了其差示热分析图。在氮气氛中,该超分子的临界分解温度(Td)从336(聚合物7a)到433℃(聚合物7h),此时95%的物质保持原样。在空气中,该分解温度稍微降低,并在被加热至800℃后,留下15-25%的残余物。在DSC扫描至300℃时也观测不到明显的相变。这表明了超分子的玻璃转变温度是极其高。
在DMAC(N,N-二甲基乙酰胺)中浓度1×10-5mol dm-3
在DMAC(N,N-二甲基乙酰胺)中浓度1×10-5g dm-3
薄膜的厚度为~38-70nm
薄膜的厚度为~0.5-2μm
作为肩峰出现
消光系数(εmax)以103×mol-1dm3cm-1为单位
表2,在DMAC中和作为薄膜的聚合物7a~7i以及在DMAC中的模型化合物5a和5b的光学物理特性
表2所列的是聚合物7a到7i的吸收和光致发光特性。表3显示的是超分子的估计的带隙。所有的超分子和模型化合物表现出相似的吸收特征,其λmax在286-290和320-346nm。通过变化超分子的结构生成紫罗兰色、蓝色、绿色和黄色的强光致发光(PL)发射。在DMAC溶液中,超分子的PL的量子产率(φ)从7b和7e的25%到7h的77%。作为浇铸薄膜的超分子的PL量子效率从7e的15%到7h的51%。
实施例13
图7显示聚合物7a的典型的UV-vis吸收光谱。在DMAC溶液中,观察到在λmax287nm(amax=73900g-1dm3cm-1)强的吸收带和在大约λmax328nm到342nm(amax=36500到28800g-1dm3cm1)的肩峰。光学带隙(吸收边缘)为3.19eV。也证实了在溶液中和用作薄膜的聚合物7a的PL光谱。在DMAC中和用作浇铸薄膜,都在λmax450nm和448nm观测到蓝色PL发射。
实施例14
图8显示在溶液中和作为薄膜的聚合物7c的PL发射光谱。在DMAC中,观察到在λmax457nm处无特色的发射带的强蓝色发射。与各自在溶液中相比,作为旋转-涂布薄膜和浇铸薄膜的聚合物的最大发射移动376cm-1。
实施例15
图9显示作为旋转-涂布薄膜的聚合物7a、7f、7g和7i的PL光谱。通过在主链中引入不同的连接或者通过侧基的取代,能够调整超分子的PL发射光色彩。这些聚合物的发射光色彩为蓝色(聚合物7a)、绿色(聚合物7f)、绿色(聚合物7g)和黄色(聚合物7i),各自的PL发射峰分别在λmax450、546、530和567nm。
实施例16
图10显示在DMAC中,作为旋转-涂布薄和浇铸薄膜的聚合物7h的标准化PL光谱。可以观察到聚合物7h在DMAC中白光发射,其最大发射在434nm,肩峰大约518nm。相反,分别证明了作为旋转-涂布薄膜和浇铸薄的7h分别具有4350cm-1的大斯托克斯移动的无结构黄光发射谱。
aLUMO水平由在DMF溶液中相对于二茂铁/铁铈齐电偶测得的还原电位而计算得到。二茂铁的绝对能级为-4.8eV。
bHOMO水平是由LUMO能级和带隙之间的能量差别而被估计。
c带隙是通过外推最低能量峰的拖尾而由DMAC中的吸收光谱估计。
表3,超分子和模型化合物的HOMO-LUMO能级和带隙
实施例17
这些超分子的相对HOMO和LUMO水平可以通过它们的还原电位和光学带隙而被估计出来。表3总结其电子特性。图11示意性说明了超分子的HOMO-LUMO水平和带隙。沿着骨架具有氧亚甲基连接的超分子HOMO-LUMO水平间的能量差距非常类似,其自7a的3.19eV到7d的3.26eV。这些聚合物在DMAC溶液中和作为薄膜各自都显示强的蓝光发射。聚合物7f、7g和7h表现出类似的电子能级,LUMO能级从-3.61eV到-3.67eV且HOMO能级从-6.56eV到-6.59eV,而且作为薄膜显示出强的绿光PL发射。聚合物7h具有2.64eV的最窄的带隙。获得了作为薄膜的聚合物的亮的黄光发射。
图12中示意性地说明了根据本发明的电致发光设备。作为本发明一个实例,制备了具有ITO/PEDOT/PPS/聚合物7a/Ca(30)/Al(120)构造的蓝光PLED。如下装配设备A:
实施例18
在带有20Ω/电阻薄片的铟-锡-氧化物(ITO)玻璃上制造设备A,在洗涤剂溶液、去离子水、乙醇和丙酮中对其进行连续清洁。润湿-清洗过程如下:
-用不含薄纱的软麻布和丙酮清洁ITO玻璃来除去粘附在玻璃上的颗粒
-在50℃、在具有玻璃洗涤剂的去离子水中超声清洗10分钟
-用去离子水充分漂洗
-在50℃乙醇中超声清洗5分钟
-用去离子水充分漂洗
-在40℃丙酮中超声清洗5分钟
湿润-清洗过程后,ITO玻璃在130℃下干燥24小时,并用UV臭氧清洁剂处理10分钟以去除痕量的有机物。通过标准的旋转-涂布方式将聚(3,4-亚乙二氧基噻吩)/(聚(苯乙烯磺酸酯))(PEDOT/PSS)和聚合物7a沉积于ITO上。PEDOT/PSS的层厚为30-100nm。聚合物7a的层厚为30-70nm。在高真空条件(6×10-6托)下进行钙(30nm)和铝(120nm)电极沉积。典型的成长速率为2/s。在大气中不带包装检测设备的EL性能。
实施例19
图13中,在10V偏置电压,聚合物7a的EL光谱显示了在450nm处发射峰。发现这与作为旋转-涂布薄膜和浇铸薄膜的相应的PL发射类似。图14中也显示了设备A的电流密度-电压-亮度特征曲线。蓝光EL强度随着偏置电压增加而增加。导通电压大约6V。设备的最大效率为0.8cd/A。在13V驱动电压下获得了1698cd/m2最大亮度。设备A的EL色彩为蓝色(CIE坐标x=0.15,y=0.21)。
实施例20
本实施例说明了具有ITO/PEDOT/PPS/聚合物7h/Ca(30)/Al(120)结构的黄光PLED的制备。设备B类似设备A被装配。
图14显示具有聚合物7h的设备B的性能。图15中提供了设备B的电流密度-电压-亮度特征曲线。设备在572nm显示强的EL发射峰。设备B的起始电压为大约6V。在13V时效率和最大亮度分别为1.1cd/A和2382cd/m2。设备B的EL色彩为黄色(CIE坐标:x=0.46,y=0.50)。
具有基于三联吡啶基团的电致发光金属-超分子专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0