IPC分类号 : C07J1/00,C07D213/82,A61K31/455,A61K31/567,A61P15/18
专利摘要
本发明公开了一种炔雌醇新晶型,该晶型是一种烟酰胺共晶药物,该晶型为单斜晶系,该晶型在高温、高湿、光照条件下稳定,且在0.2%SDS和0.5%SDS溶液中具有较好的溶解度,有助于提高药物的生物利用度。
权利要求
1.一种炔雌醇药物共晶,其特征在于,所述的药物共晶是以炔雌醇为活性成分,以烟酰胺为共晶形成物,两者采用氢键相连,药物共晶的实验式为C26H30N2O3。
2.根据权利要求1所述的炔雌醇药物共晶,其特征在于,所述药物共晶为单斜晶系,P2(1)空间群,晶胞参数为 α=γ=90°,β=99.603(6)°,Z=2,晶胞体积为
3.根据权利要求1所述的炔雌醇药物共晶,其特征在于,使用Cu-Kα辐射,以2θ角度表示的X-射线粉末衍射在约11.30°、14.25°、16.14°、18.43°处存在特征衍射峰。
4.根据权利要求3所述的炔雌醇药物共晶,其特征在于,使用Cu-Kα辐射,以2θ角度表示的X-射线粉末衍射还在约12.51°、13.28°、17.20°、18.12°、21.90°、22.27°、24.50°、25.07°、27.31°、28.98°处有特征衍射峰。
5.根据权利要求1所述的炔雌醇药物共晶,其特征在于,使用红外吸收光谱分析,在1675、1448、1225、1017、874、639cm-1处有特征吸收峰。
6.权利要求1-5任一项所述的炔雌醇药物共晶的制备方法,其特征在于,将炔雌醇与烟酰胺加入研钵中,用乙腈溶剂辅助研磨1h,即得白色粉末样品。
7.根据权利要求6所述的制备方法,其特征在于,炔雌醇与烟酰胺的摩尔比为1:1。
8.权利要求1-5任一项所述的炔雌醇药物共晶在制备避孕药物中的应用。
9.权利要求1-5任一项所述的炔雌醇药物共晶在制备治疗妇科疾病的药物组合物中的应用。
10.一种药物组合物,其特征在于,包括权利要求1-5任一项所述的炔雌醇药物共晶以及药学上可接受的载体。
说明书
技术领域
本发明属于医药领域,涉及一种炔雌醇药物共晶及其制备方法,具体的涉及一种炔雌醇-烟酰胺共晶。
背景技术
炔雌醇为3-羟基-19-去甲-17α-孕甾-1,3,5(10)-三烯-20-炔-17-醇,实验式为C20H24O2。炔雌醇为白色或类白色的结晶性粉末,无臭,在乙醇、丙醇或乙醚中易溶,在氯仿中溶解,在水中不溶。炔雌醇可用于补充雌激素不足,治疗女性性腺功能不良、闭经、更年期综合征等;用于晚期乳腺癌(绝经期后妇女)、晚期前列腺癌的治疗;与孕激素类药合用,能抑制排卵,可作避孕药;还用于小儿隐睾症及雄激素过多、垂体肿瘤等;用于诊断下丘脑-腺垂体-性腺功能障碍。
口服避孕药物是育龄妇女、特别是未婚、未育女性最常采取的避孕节育措施。口服避孕药物多为甾体激素类药物,过量服用会导致排卵异常甚至不孕,从而严重影响我国育龄妇女的生殖健康,威胁我国下一代出生人口数量和素质。水溶性差是甾体类化合物的共性问题,炔雌醇需要大剂量口服(0.02-1毫克/天)才能达到必要的血药浓度。提高甾体激素类药物的水溶性和生物利用度,降低口服剂量是目前我国口服避孕药亟待解决的问题。
在制药过程中,我们经常是根据药物自身性质和对目标制剂的要求来选择药物的剂型,药物的疗效在很大程度上依赖于其剂型和型态。而大多数的药物为固体型态,不同固体晶型的药物对药品质量的影响是不同的。在制剂研究中,药物的不同固体型态具有不同的颗粒性质及粉体性质,如粒子的外观、大小、孔隙率和粉末的流动性等,这些因素都会影响到药物产品的质量甚至严重影响临床疗效。因此,药物固体形态的选择是药物制剂研究的重中之重。
药物共晶作为一种新型的药物固体存在形式,它对药物制剂的熔点、定性、溶解度和生物利用度等许多方面有着不可忽视的作用。通过对药物共晶的设计开发出更多原料药新剂型和改善原料药的理化性质及疗效使得药物共晶成为药物研发的一个新兴领域。
发明内容
为了弥补现有技术的不足,本发明的目的在于提供一种炔雌醇的新晶型,以改善炔雌醇原料药的溶解度小,生物利用度低的缺点。
为了实现上述目的,本发明采用如下技术方案:
本发明提供了一种炔雌醇药物共晶,所述的药物共晶是以炔雌醇为活性成分,以烟酰胺为共晶形成物,两者采用氢键相连,药物共晶的实验式为C26H30N2O3。
进一步,所述药物共晶为单斜晶系,P2(1)空间群,晶胞参数为 α=γ=90o,β=99.603(6)o,Z=2,晶胞体积为
进一步,使用Cu-Kα辐射,以2θ角度表示的X-射线粉末衍射在约11.30°、14.25°、16.14°、18.43°处存在特征衍射峰。
进一步,使用Cu-Kα辐射,以2θ角度表示的X-射线粉末衍射还在约12.51°、13.28°、17.20°、18.12°、21.90°、22.27°、24.50°、25.07°、27.31°、28.98°处有特征衍射峰。
进一步,使用红外吸收光谱分析,在1675、1448、1225、1017、874、639cm-1处有特征吸收峰。
本发明提供了一种上述炔雌醇药物共晶的制备方法,具体步骤为:将炔雌醇与烟酰胺加入研钵中,用乙腈溶剂辅助研磨1h,即得白色粉末样品。
进一步,炔雌醇与烟酰胺的摩尔比为1:1。
本发明提供了上述的炔雌醇药物共晶在制备避孕药物中的应用。
本发明提供了上述的炔雌醇药物共晶在制备治疗妇科疾病的药物组合物中的应用,其中妇科疾病包括功能失调性子宫出血、多囊卵巢综合征、子宫内膜异位症、子宫腺肌病、原发性痛经、闭经等。
本发明提供了一种药物组合物,该药物组合物包括上面所述的炔雌醇药物共晶以及药学上可接受的载体。
药学上可接受的载体包括(但不限于)稀释剂、粘合剂、表面活性剂、致湿剂、吸附载体、润滑剂、填充剂、崩解剂,该组合物的恰当形式要根据用药的方式确定。
通过混合制备的并适合于口服、肠胃外或局部给药的药物组合物其剂型可以是片剂、口服液体制剂、粉剂、锭剂、软锭剂、可再配的粉剂、注射和灌注的溶液或混悬液、栓剂和经皮组件。可口服的组合物是优选的,特别是具有形状的口服组合物,因为它们通常便于使用。
口服的片剂和胶囊通常是单位剂量的,并含有常用的赋型剂如粘结剂、填料、稀释剂、成片剂、润滑剂、着色剂、调味剂和湿润剂。这些片剂可以按本领域已知的方法包衣。
适合使用的填料包括淀粉、聚乙烯吡咯烷酮和淀粉衍生物如羟基乙酸淀粉钠。合适的润滑剂例如包括硬脂酸镁。合适的用药可接受的湿润剂包括十二烷基硫酸钠。
固体口服组合物可以用共混、填充、制片等常用方法制备。可以采用反复的共混操作将活性剂全面分布到用大量填料的那些组合物中。这样做法在本领域中自然是很方便的。
口服液体制剂的形式例如可以是水性或油性的混悬液、溶液、乳液、糖浆或酏剂,或者可以是干燥的在使用前可用水或其它适宜的载体再组配的产品。这种液体制剂可以含常用的添加剂例如悬浮剂如山梨醇、糖浆、甲基纤维素、明胶、羟乙基纤维素、羧甲基纤维素、硬脂酸铝凝胶或食用氢化脂肪;乳化剂例如卵磷脂、脱水山梨醇单油酸脂或阿拉伯胶;非水性载体(可包括食用油)例如杏仁油、馏分可可油、油状的酯如甘油、丙二醇或乙醇的酯;防腐剂例如对羟基苯甲酸甲酯或乙酯、或山梨酸,以及如果需要还可包括常用的调味剂或着色剂。
对于非肠胃道给药,将本发明化合物和灭菌载体配制成流体单位剂型。该化合物可以是悬浮的或者也可以是溶解的,非肠胃道给药溶液的配制一般是将活性化合物溶解在载体中,在灌入适当的小瓶或安瓿并进行密封之前先进行过滤灭菌。最好将一些辅剂如局部麻醉剂、防腐剂和缓冲剂也溶在载体中。为了提高药物组合物的稳定性,在灌入小瓶和真空除去水份之后可将其冷冻。
非肠胃道用混悬液用基本上相同的方式配制,只是活性化合物是悬浮在载体里的而不溶解,并在悬浮到灭菌载体里之前通过用环氧乙烷处理使其灭菌。该组合物中最好加有表面活性剂或湿润剂以利于活性化合物的均匀分布。
对于局部给药用的组合物可以是全身传递化合物的经皮软膏或贴片,其制备可以用如标准教科书‘Dermatological Formulations’-B.W.Barry(Drugs andPharmaceutical Sciences-Ddkker)或Harrys Cosmeticology(Leonard Hill Books)中所述的常用方法。
本发明的优点和有益效果:
本发明的炔雌醇-烟酰胺药物共晶具有较好的稳定性,且溶解性具有较大改善,有助于提高生物利用度。
附图说明
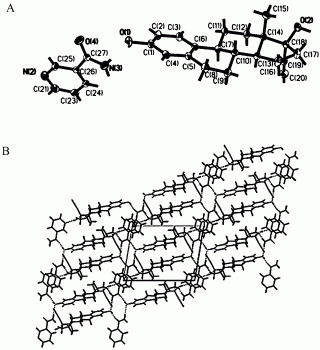
图1是炔雌醇-烟酰胺的单晶结构图,其中图A是分子结构图;图B是沿b轴方向的氢键连接图;
图2是炔雌醇-烟酰胺药物共晶的X-射线粉末衍射(PXRD)图谱;
图3是炔雌醇-烟酰胺药物共晶的TGA/DSC热分析图谱;
图4是炔雌醇-烟酰胺药物共晶的红外(IR)扫描图谱;
图5是炔雌醇-烟酰胺药物共晶的1H-NMR核磁共振图谱;
图6是炔雌醇-烟酰胺药物共晶在不同介质中的溶解曲线图;其中图A是在0.2%SDS中的溶解曲线图;图B是在0.5%SDS中的溶解曲线图。
具体的实施方式
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
实施例1炔雌醇药物共晶的制备
分别取296.4mg炔雌醇与122.1mg烟酰胺加入研钵中,用乙腈溶剂辅助研磨1h,即得白色粉末样品。
实施例2炔雌醇药物共晶的单晶-X射线衍射(SXRD)检测
1、使用德国Bruker公司APEX II CCD area-detector型X-射线单晶衍射仪,选取0.30mm×0.24mm×0.22mm大小的无色晶体,采用石墨单色化Mo-Kα射线,辐射波长 测定温度:293(2)K。结构解析和精修采用SHELXT-97(Version 5.1)程序完成。利用直接法确定原子位置,然后用差值函数法和最小二乘法求出全部非氢原子坐标,用最小二乘法对结构进行修正。
2、结果
结果如表1和图1所示,炔雌新晶型为炔雌醇-烟酰胺药物共晶,对具体的单晶结构解析可知,在炔雌醇-烟酰胺晶体结构上不含有溶剂分子,炔雌醇与烟酰胺通过氢键相连,二者之间的比例为1:1。
表1炔雌醇-烟酰胺共晶的结晶学参数
实施例3炔雌醇药物共晶的PXRD检测
1、样品
炔雌醇-烟酰胺共晶样品(EE-NTA)
2、X-射线粉末衍射检测仪的设定
使用德国Bruker公司D8 ADVANCE型X射线粉末仪进行检测,具体采集信息如下:铜靶,40KV/40mA,起始角5°,终止角40°,步宽0.02,扫描速度17.7s/步,波长 石墨单色器,连续扫描。
理论谱图:理论谱图采用Mercury软件进行模拟得到。软件可以在网站下载:https://www.ccdc.cam.ac.uk/solutions/csd-system/components/mercury/
3、结果
结果如表2和图2所示,炔雌醇药物共晶的X-射线粉末衍射图谱在2θ值的相应位置对应有特征衍射峰,研磨粉末与单晶解析的理论值在峰的强度和位置上是一致的,说明研磨的粉末样品与EE-NTA单晶具有相同的空间结构,晶型是一致的。
表2炔雌醇药物共晶的X-射线粉末衍射图的表征数据
实施例4炔雌醇药物共晶的TG-DSC热分析检测
1、使用NETZSCH STA 449C热重-差示扫描热量仪和Perkin Elmer TGA-7量分析仪(TG)对炔雌醇药物共晶进行TG-DSC热分析,升温速率:10℃/min,温度范围:25--500℃
2、结果
TG-DSC检测结果如图3所示,差示扫描热量仪(DSC)显示:在测试温度范围内(25---500℃),样品炔雌醇-烟酰胺在25-500℃未观察到熔点;热重分析(TG)显示:样品炔雌醇-烟酰胺在174.9℃分解失重,而在174.9℃以前,TG曲线无失重,提示该药物不含结晶水。
实施例5炔雌醇药物共晶的红外(IR)分析
1、使用铂金埃尔默公司Spectrum Two型红外光谱仪对新晶型进行红外光谱分析,
2、结果
结果如图4和表3所示,炔雌醇-烟酰胺在1675、1448、1225、1017、874、639cm-1等处存在特征吸收峰。
表3炔雌醇-烟酰胺的红外吸收光谱
实施例6炔雌醇药物共晶的1H-NMR核磁共振谱分析
1、使用Bruker AVANCE III 400MHz型核磁共振波谱仪进行检测,溶剂为CD3OD。
2、结果
结果如图5所示,核磁共振氢谱的位移如下:1H NMR(400MHz,Methanol-d4)δ9.02(d,J=2.4Hz,1H),8.68(dd,J=4.9,1.4Hz,1H),8.28(dt,J=10.04,2.0Hz,1H),,7.58-7.51(dd,1H),7.08(d,J=8.4Hz,1H),6.54(dd,J=8.4,2.6Hz,1H),6.47(d,J=2.5Hz,1H),2.89(s,1H),2.81-2.72(m,2H),2.34(d,J=13.1Hz,1H),2.28-2.22(m,1H),2.13(t,J=11.0Hz,1H),2.02-1.84(m,3H),1.74(d,J=11.1Hz,3H),1.48-1.23(m,4H),0.86(s,3H).
实施例7炔雌醇药物共晶的物理化学稳定性研究
对得到的炔雌醇-烟酰胺共晶进行以下实验,取样进行XRPD实验。
1、高温试验:将晶型样品置洁净烧杯中,在60℃温度下放置10天,并于第0天、第5天和第10天取样。
2、高湿试验:将晶型样品置洁净烧杯中,在25℃于相对湿度90%±5%条件下放置10天,并于第0天、第5天和第10天取样。
3、光照试验:晶型样品置洁净烧杯中,放在装有日光灯的光照箱,于照度为4500lx±500lx的条件放置10天,并于第0天、第5天和第10天取样。
4、结果
经X射线粉末衍射测式,主要2θ角均未发生显著变化,说明炔雌醇药物共晶在高温、高湿、光照下稳定。
实施例8炔雌醇-烟酰胺共晶的溶出行为研究
为了掌握晶型状态与晶型溶解性质的关系,对炔雌醇-烟酰胺共晶进行溶解性质评价。
1、溶媒系统的选择和配制
溶媒系统的选择:设置了水、0.2%SDS溶液、0.5%SDS溶液、pH值为1.2的0.1M盐酸溶液、pH值为4.5的醋酸盐缓冲液、pH值为6.8的磷酸盐缓冲液这6个溶媒系统,来考察炔雌醇-烟酰胺共晶的溶解性质。
2、溶解曲线测定
实验方法:称取炔雌醇(EE)、炔雌醇-烟酰胺共晶(CO)样品于圆底烧瓶中,加入溶液,于25±2℃,250rmp下搅拌,分别于5、15、30、60、120、240、300min取样,过滤,续取滤液,用高效液相色谱法检测,检测条件:流动相为水-乙腈(1:1),总流速为1mL/min,检测波长为220nm。
3、结果
通过试验,发现在水、pH值为4.5的醋酸盐缓冲液、pH值为6.8的磷酸盐缓冲液这3个溶媒系统中,无法检测出炔雌醇、炔雌醇-烟酰胺共晶;在pH值为1.2的0.1M盐酸溶液中,炔雌醇、炔雌醇-烟酰胺共晶的溶解性质一致,而在0.2%SDS和0.5%SDS溶液中,炔雌醇-烟酰胺共晶溶解性比炔雌醇好(图6所示)。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
一种炔雌醇药物共晶及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0