专利摘要
本发明公开了一种表达R构型选择性的脂肪酶的重组菌及其应用,将R构型选择性的脂肪酶基因插入pET28a质粒的多克隆位点得到的重组质粒;再将所述重组质粒转化大肠杆菌SHuffleT7,得到重组菌;所述R构型选择性的脂肪酶基因为如下1)或2)的DNA序列:1)序列表中SEQIDNO.2所示的DNA序列;2)与1)限定的DNA序列具有90%以上同源性且编码具有酯水解酶活性的蛋白的DNA序列。本发明重组的脂肪酶具有较高R‑构型立体选择性和催化活力,在较高温条件下酶活保留大于85%,可用于拆分外消旋2‑芳基丙酸甲酯类物质,获取光学纯的S‑型2‑芳基丙酸甲酯类物质。
权利要求
1.一种表达R构型选择性的脂肪酶的重组菌,其特征在于,将R构型选择性的脂肪酶基因插入pET28a质粒的多克隆位点得到的重组质粒;再将所述重组质粒转化大肠杆菌SHuffle T7,得到重组菌;
所述R构型选择性的脂肪酶基因为:SEQ ID NO.2所示的DNA序列。
2.权利要求1所述重组菌在降解酯类中的应用,其特征在于,所述酯类为对硝基苯酚乙酸酯、对硝基苯酚丁酸酯、对硝基苯酚己酸酯、对硝基苯酚辛酸酯、对硝基苯酚癸酸酯、对硝基苯酚月桂酸酯、三乙酸甘油酯、三丁酸甘油酯、三己酸甘油酯、三辛酸甘油酯、三月桂酸甘油酯和三硬脂酸甘油酯中的任意一种或两种以上。
3.根据权利要求2所述的应用,其特征在于,所述脂肪酶降解酯类时,反应温度为40±10℃,反应pH为7.5±0.5。
4.权利要求1所述重组菌在立体选择性催化拆分外消旋2-芳基丙酸类物质中应用。
5.根据权利要求4所述的应用,其特征在于,所述外消旋2-芳基丙酸类物质为萘普生甲酯((±)-2-(6-甲氧基-2-萘基)丙酸甲酯)、布洛芬甲酯((±)2-(4-异丁基苯基)丙酸甲酯)和氟比洛芬甲酯((±)2-(2-氟-4-联苯)丙酸甲酯)中的任意一种或两种以上。
说明书
技术领域
本发明涉及一种R构型选择性的脂肪酶AflB及其编码基因,以及含有该编码基因的载体、工程菌及其在手性拆分外消旋体2-芳基丙酸类物质的应用。
背景技术
脂肪酶广泛存在于动物、植物及微生物中,是一类催化水解或形成酯键的酶,作用底物通常是脂肪酸链大于十个碳原子的酯类。脂肪酶能催化水解、酯化、转酯等多种化学反应,是一种很重要的工业催化剂。另外,脂肪酶对底物的广谱性/特殊专一性,赋予了脂肪酶在酯键化合物的合成和手性药物合成等工业的巨大应用价值。
由于对手性药物和中间体需求的增长,利用生物法或酶法合成或拆分手性化合物日益得到人们的重视和工业化应用。如2-芳基丙酸类非甾体抗炎药物具有解热、消炎、镇痛的作用,主要治疗风湿性脊椎炎、类风湿性关节炎及产后、术后止痛等,在临床上应用广泛。但是研究发现,2-芳基丙酸类物质存在一对光学活性对映体,而真正具有治疗作用的S-构型分子(例如(S)-萘普生的药效是(R)-萘普生的28倍,且(R)-萘普生与辅酶A会形成酯,扰乱人体正常的膜功能及脂代谢等,给人体带来一定的毒副作用)。因此,为了用药安全,在临床上须使用纯(S)-2-芳基丙酸。所以,研究一种高效、低成本酶法拆分2-芳基丙酸类物质的方法就变得非常重要。
酶法拆分手性化合物的关键问题在于寻找具有高度立体选择性催化功能的生物催化剂。虽然脂肪酶在微生物界分布很广,但它们的立体选择性催化功能不一样,通过对微生物发酵产物的分离纯化得到单一的酶制剂来进行催化反应,往往需要较复杂的工艺和较高的成本,在生产中不易被采用。
发明内容
本发明的目的旨在至少解决现有技术中存在的技术问题之一。为此,本发明需要提供一种R构型选择性脂肪酶以及含有该编码基因的载体、工程菌及其应用。
本发明采用的技术方案如下:
一种具有R-异构体立体选择性的脂肪酶AflB,其氨基酸序列如SEQ ID NO.1所示。
由于氨基酸序列的特殊性,任何含有SEQ ID NO.1所示氨基酸序列的肽蛋白的片段或其变体,如其保守性变体、生物活性片段或衍生物,只要该肽蛋白的片段或肽蛋白变体与前述氨基酸序列同源性在90%以上,均属于本发明保护范围之列。具体的所述改变可包括氨基酸序列中氨基酸的缺失、插入或替换;其中,对于变体的保守性改变,所替换的氨基酸具有与原氨基酸相似的结构或化学性质,如用亮氨酸替换异亮氨酸,变体也可具有非保守性改变,如用色氨酸替换甘氨酸。
一种含有R构型选择性的脂肪酶AflB编码基因的质粒pET28a-AflB,R构型选择性的脂肪酶AflB编码基因序列如SEQ ID NO.2所示或与SEQ ID NO.2具有90%以上同源性且编码具有酯水解酶活性的蛋白的DNA序列,再通过全基因合成将上述脂肪酶基因克隆到pET28a质粒上得到质粒pET28a-AflB。
一种表达R构型选择性的脂肪酶的重组菌,通过将质粒pET28a-AflB转化大肠杆菌宿主菌E.coli Shuffle T7得到重组菌E.coli Shuffle T7/pET28a-AflB。
一种R构型选择性的脂肪酶AflB的制备方法,其中包括如下步骤:培养本发明所述的生产菌株E.coli Shuffle T7/pET28a-AflB,从培养物中获得重组R构型选择性的脂肪酶AflB。
其中所述的制备方法可采用本领域常规的培养方法。对于大肠杆菌,较佳地为:将上述重组表达转化体接种至含有50μg/ml卡那霉素的LB培养基中,37℃,200rpm培养,培养液的光密度OD600达到0.8,加入0.05mM的异丙基-β-D-硫代吡喃半乳糖苷(IPTG)进行诱导,诱导温度为20℃,诱导24小时即可得到高效表达的重组R构型选择性的脂肪酶AflB。
上述重组R构型选择性的脂肪酶AflB在降解酯类中的应用。所述脂肪酶降解酯类时,反应温度为40±10℃,反应pH为7.5±0.5。
所述重组R构型选择性的脂肪酶AflB可以水解如下任意一种酯类:对硝基苯酚乙酸酯(p-nitrophenyl acetate;pNC2)、对硝基苯酚丁酸酯(p-nitrophenyl butyrate;pNC4)、对硝基苯酚己酸酯(p-nitrophenyl caproate;pNC6)、对硝基苯酚辛酸酯(p-nitrophenyl caprylate;pNC8)、对硝基苯酚癸酸酯(p-nitrophenyl caprate;pNC10)、对硝基苯酚月桂酸酯(p-nitrophenyl laurate,pNC12)、三乙酸甘油酯(Triacetin,TriC2)、三丁酸甘油酯(Tributyrin,TriC4)、三己酸甘油酯(Tricaproin,TriC6)、三辛酸甘油酯(Tricaprylin,TriC8)、三月桂酸甘油酯(Trilaurin,TriC12),三硬脂酸甘油酯(Tristearin,TriC18)。
所述重组R构型选择性的脂肪酶AflB水解所述酯类时,最适反应温度为40-50℃,最适反应pH为7.0-8.0。偏好水解短链脂肪酸甘油酯,50℃条件下孵育2h酶活保留大于85%,并且耐受正己烷、甲苯、乙醚等有机溶剂。
重组R构型选择性的脂肪酶AflB在立体选择性催化拆分外消旋底物制备手性化合物中的应用。
所述外消旋底物为:萘普生甲酯((±)-2-(6-甲氧基-2-萘基)丙酸甲酯)、布洛芬甲酯((±)2-(4-异丁基苯基)丙酸甲酯)和氟比洛芬甲酯((±)2-(2-氟-4-联苯)丙酸甲酯)等底物中的任意一种或两种以上。
与现有技术相比,本发明具有如下优点和有益效果:
(1)关于脂肪酶的优点:本发明脂肪酶具有较高R-构型立体选择性和催化活力,偏好水解短链脂肪酸甘油酯,在较高温条件下酶活保留大于85%,并且耐受正己烷、甲苯、乙醚等有机溶剂。
(2)本发明重组的脂肪酶AflB可用于拆分外消旋2-芳基丙酸甲酯类物质,获取光学纯的S-型2-芳基丙酸甲酯类物质(光学纯度>98.5%)。
(3)本发明提供了一种制备高R-构型立体选择性和催化活力脂肪酶的方法,其有益之处在于应用了大肠杆菌表达系统,可以以较低成本和高效地获得酶蛋白。
附图说明
图1为重组R构型选择性的脂肪酶AflB的表达和纯化过程中的电泳结果:1:重组菌诱导表达后得到破碎全菌液;2:重组菌诱导表达后得到破碎上清液;3:重组菌诱导表达后得到破碎沉淀重悬液;4:重组菌诱导表达后得到破碎上清液过Ni柱后得到的洗脱液;5:Ni柱洗脱液过Q Sepharose FF后得到的洗脱液;M:低分子量蛋白质分子Marker。
图2为重组R构型选择性的脂肪酶AflB在不同pH下的比活性。
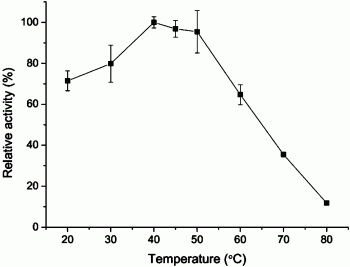
图3为重组R构型选择性的脂肪酶AflB在不同温度下的比活性。
图4为重组R构型选择性的脂肪酶AflB对不同底物的比活性。
图5为重组R构型选择性的脂肪酶AflB在不同温度下的热稳定性。
图6为重组R构型选择性的脂肪酶AflB催化反应后经色谱分离的(S)一萘普生甲酯、(R)一萘普生和(S)一萘普生的图谱。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例1
R构型选择性的脂肪酶AflB的发现
通过蛋白数据库的挖掘,发现一条Aspergillus fumigatus Af293lipase(GenBank:XP_749106)氨基酸序列,发现该酶与工业上广泛使用的脂肪酶CalB表现了较低的序列一致性Identity=31%,并含有一个CalB不具有的N端α螺旋结构域。通过同源建模及底物分子对接发现,N端α螺旋结构域有利于R构型萘普生((-)-2-(6-甲氧基-2-萘基)丙酸)的结合。并且在该分子对接的基础上,通过计算机模拟置换底物口袋相应氨基酸残基,进一步改造Aspergillus fumigatus Af293lipase,让其更倾向结合R构型萘普生。最后将这改造后的Aspergillus fumigatus Af293lipase命名为R构型选择性的脂肪酶AflB,该酶由438个氨基酸残基组成,理论等电点为5.4。
将编码R构型选择性的脂肪酶AflB的基因命名为脂肪酶AflB,其开放阅读框如SEQID NO.2所示,由1314个核苷酸组成。
实施例2
R构型选择性的脂肪酶AflB的表达和纯化
一、重组质粒的构建
脂肪酶AflB编码基因序列如SEQ ID NO.2所示,通过全基因合成获得脂肪酶AflB基因,然后克隆到pET28a质粒上得到质粒pET28a-AflB。
二、重组R构型选择性的脂肪酶AflB生产菌的获得
取大肠杆菌SHuffle T7Competent E.coli(Cat.C3026,NEB)感受态细胞一管,于冰上融化,以预冷的移液管枪尖转移50ul于预冷的1.5ml离心管中,然后加入重组质粒pET28a-AflB 1ul,轻摇混匀,冰浴放置30分钟。迅速转移到42℃水浴中,准确放置40秒。迅速转移到冰上,冷却2分钟。每管加入500ul LB培养液,于37℃培养45分钟。涂布20ul于含抗生素的平板(50mg/m卡那霉素)过夜培养。得到重组E.coli SHuffle T7/pET28a-AflB。
三、重组R构型选择性的脂肪酶AflB的表达和纯化
1、R构型选择性的脂肪酶AflB蛋白溶液的制备
(1)挑取重组菌E.coli SHuffle T7/pET28a-AflB,加入2L LB液体培养基(含50ug/ml卡那霉素)中,37℃摇床培养至OD600约为0.8;加入诱导剂IPTG(终浓度0.05mM),20℃诱导24h;6000rpm离心10分钟,收集菌体,加入50mM磷酸缓冲液(pH7.4)(每克菌体加10mL缓冲液),超声波破碎10分钟(60W,超声2s,停止2s),10000rpm离心20min,收集上清,即为粗酶液(蛋白质浓度为12mg/ml,总体积约250ml)。
(2)将粗酶液上样于GE Healthcare公司生产的带Ni的IDA琼脂糖5mL预装柱;然后用20ml溶液A(20mM pH7.4PB,0.5M NaCl,25mM咪唑)冲洗柱子,以去除大部分杂蛋白;然后用20ml溶液B(20mM pH7.4PB,0.5M NaCl,125mM咪唑)洗脱,收集洗脱液(蛋白质浓度为1.5mg/ml,总体积约25ml)。
(3)将洗脱液用快速蛋白液相色谱系统(FPLC;GE Healthcare)进行脱盐:采用G25desalting柱(GE Healthcare),平衡和洗脱缓冲液为20mM pH7.9Tris-Cl,流速2mL/min收集具有蛋白峰的洗脱液,即脱盐后洗脱液。
(4)将脱盐后洗脱液进行阴离子交换层析,具体参数如下:Q Sepharose FF(1.0×5cm);首先用20ml溶液QA(20mM pH7.9Tris-Cl)冲洗柱子,以去除部分杂蛋白;然后用20ml溶液B(20mM pH7.9Tris-Cl,50mM NaCl)洗脱,收集洗脱液(蛋白质浓度为1mg/ml,总体积约20ml)。
(5)将步骤(4)的洗脱液经过截留子量10KDa的超滤管AmiconUltra-15(Millipore),使体积浓缩至1ml,即为R构型选择性的脂肪酶AflB蛋白溶液(蛋白浓度为20mg/ml),用EP管分装成100ul每份-80℃保藏备用。
2、将步骤1中各个步骤得到的溶液进行聚丙烯酰胺凝胶电泳,见图1。
四、酶活测定
1、比色法测酯酶水解活力
标准曲线的测定:分别取0μL,2μL,4μL,6μL,8μL,10μL的10mM对硝基苯酚于96孔酶标板,使用相应的缓冲液将每个孔补齐至100μL,然后加入100μL的异丙醇,混合均匀后测定405nm处的吸光值,从而得到吸光值(Y轴)与对硝基苯酚浓度(X轴)之间的关系。
样品的测定:在96孔酶标板中依次加入80μL 50mM磷酸缓冲液(pH7.0),10μL 10mM对硝基苯酚辛酸酯(p-nitrophenyl caprylate;pNC8)(Sigma),置于40℃培养恒温箱预热5min的,接着加入10μL适当稀释的酶液,反应15min后加入100μL的异丙醇终止反应,测定405nm处的吸光值。空白组采用煮沸处理的酶液。重复三次,记录其平均值。
酶活力(U):将在一定条件下,单位时间内脂肪酶生成1μmol对硝基苯酚所需的酶量为一个脂肪酶活力单位(U)。
以对硝基苯酚辛酸酯为底物,经Q Sepharose FF纯化之后的洗脱液的R构型选择性的脂肪酶AflB的比酶活为500±40U/mg。
2、碱滴定法测酯酶水解活力
在三角瓶中加入三丁酸甘油酯乳化液4mL(其中三丁酸甘油酯含量25%(v/v),4%的聚乙烯醇含量75%(v/v)并于10 000rpm下均质10min)和50mM磷酸缓冲液(pH7.0)5mL,于40℃的恒温磁力搅拌器中预热5min,然后加入适当稀释的酶液1mL,并开始计时,保温反应15min后立即加入95%的乙醇15mL终止反应;加入酚酞指示剂,用标定过的浓度约为50mMKOH溶液滴定水解释放出的游离脂肪酸,记录KOH消耗的体积;空白试验是在预热后的反应体系中先加入95%的乙醇再加入热失活处理过的酶液1mL,冷却至室温后使用后反应15min,其他操作同前。
酶活力的定义为:在上述条件下,单位时间内(每分钟)生成1μmol可滴定脂肪酸所需的酶量为1个活力单位(U)。
以三丁酸甘油酯为底物,经Q Sepharose FF纯化之后的洗脱液的R构型选择性的脂肪酶AflB的比酶活为11000±320U/mg。
实施例3
重组R构型选择性的脂肪酶AflB的酶学性质测定
一、重组R构型选择性的脂肪酶AflB的最适反应pH值
在40℃下,以三丁酸甘油酯作为底物,分别在pH 3.0,4.0和5.0(50mM醋酸钠缓冲液)、pH 6.0和pH 7.0(50mM磷酸盐缓冲液)、pH 8.0(50m M Tris-HCl缓冲液)、pH 9.0和pH10.0(50mM甘氨酸缓冲液)条件,测定不同的pH对实施例2中的重组R构型选择性的脂肪酶AflB的相对酶活(图2)。
二、重组R构型选择性的脂肪酶AflB的最适反应温度
以三丁酸甘油酯作为底物,在pH 7.0(50mM磷酸盐缓冲液)条件下,分别在20℃、30℃、40℃、45℃、50℃、60℃、70℃和80℃,的条件下进行催化反应,测定实施例2中的重组R构型选择性的脂肪酶AflB的相对酶活(图3)。
三、重组R构型选择性的脂肪酶AflB对不同链长底物的选择性
分别以三乙酸甘油酯(TC2)、三丁酸甘油酯(TC4)、三辛酸甘油酯(TC8)、三月桂酸甘油酯(TC12)和橄榄油(Olive oil)乳化液作为底物,在pH 7.0(50mM磷酸盐缓冲液)条件下,40℃的条件下进行催化反应,测定实施例2中的重组R构型选择性的脂肪酶AflB的相对酶活(图4)。
四、重组R构型选择性的脂肪酶AflB的温度稳定性
将一定量的实施例2中的重组R构型选择性的脂肪酶AflB至于30℃、50℃、60℃、70℃条件下孵育,分别在孵育0min,10min,20min,40min和70min的时间点取样,在40℃,pH7.0(50mM磷酸盐缓冲液)条件,以三丁酸甘油酯为底物测定各个样品的相对酶活(图5)。
五、重组R构型选择性的脂肪酶AflB对不同有机溶剂的耐受性
取实施例2中的重组R构型选择性的脂肪酶AflB以50%的比例,与不同的有机溶剂在4℃条件下孵育2h,然后在40℃,pH 7.0(50mM磷酸盐缓冲液)条件,以三丁酸甘油酯为底物测定各个样品的相对酶活(表1)。
表1.有机溶剂对于重组R构型选择性的脂肪酶AflB活力的影响
从结果可知,重组R构型选择性的脂肪酶AflB水解所述酯类时,最适反应温度为40-50℃,最适反应pH为7.0-8.0,偏好水解短链脂肪酸甘油酯,50℃条件下孵育2h酶活保留大于85%,并且耐受正己烷、甲苯、乙醚等有机溶剂。
实施例4重组R构型选择性的脂肪酶AflB在立体选择性催化拆分外消旋2-芳基丙酸类物质的应用
取实施例2中的重组R构型选择性的脂肪酶AflB,水解外消旋的萘普生甲酯((±)-2-(6-甲氧基-2-萘基)丙酸甲酯)、布洛芬甲酯((±)2-(4-异丁基苯基)丙酸甲酯)和氟比洛芬甲酯((±)2-(2-氟-4-联苯)丙酸甲酯)等底物,反应溶剂为50mM pH7.0磷酸盐酸缓冲液、底物浓度分别为5%(体积比),酶用量为0.05mg/mL,反应温度25℃。反应150min后,反应产物经高效液相色谱和手性柱(Chiralccl OJ,Japan,Daicel chemical,4.6mmx250mm)分析(S)型酯底物产率和光学纯度,如图5所示,其中(S)-萘普生甲酯((S)-(+)-2-(6-甲氧基-2-萘基)丙酸甲酯)、(R)-萘普生((R)-(-)-2-(6-甲氧基-2-萘基)丙酸)和(S)-萘普生((S)-(+)-2-(6-甲氧基-2-萘基)丙酸)的液相色谱保留时间分别为6.9min、11.4min和12.3min,具体运行方法如下:流动相:正己烷/异丙醇(95/5,v/v,1.0mL/min),柱温:28℃,样品浓度:0.1-1.0mmol/mL,压强范围:0-9.0MPa,检测波长:UV254nm。
表2重组酯水解酶催化拆分不同外消旋2-芳基丙酸甲酯的反应结果
从结果可知,不同的外消旋2-芳基丙酸底物经过重组R构型选择性的脂肪酶AflB催化水解后,均得到光学纯度>98.6%的S构型甲酯相应产物。说明重组R构型选择性的脂肪酶AflB在制备光学纯的S构型旋2-芳基丙酸类药物领域有着良好的应用前景。
以上所述,仅是本发明的较佳实施例而已,并非对本发明的技术内容作任何形式上的限制。凡是依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均落入本发明的保护范围内。
序列表
<110>华南理工大学
<120>一种表达R构型选择性的脂肪酶的重组菌及其应用
<160>2
<170>SIPOSequenceListing 1.0
<210>1
<211>438
<212>PRT
<213>人工序列(Artificial Sequence)
<400>1
Ala Val Ile Pro Arg Gly Ala Val Pro Val Ala Ser Asp Leu Thr Ile
1 5 1015
Leu Thr Val Ile Thr Thr Gly Gly Gln Glu Thr Thr Leu Asp Thr Asp
202530
Ala Lys Ser Ile Ala Ser Leu Ile Ala Ser Glu Ile Val Ser Lys Ile
354045
Gly Lys Thr Glu Phe Ser Arg Ser Thr Lys Asp Ala Lys Ser Val Gln
505560
Glu Ala Phe Asp Lys Ile Gln Ser Ile Phe Ala Asp Gly Thr Pro Asp
65707580
Phe Leu Lys Met Thr Arg Glu Ile Leu Thr Val Gly Leu Ile Pro Ala
859095
Asp Ile Leu Ser Phe Leu Asn Gly Tyr Leu Asn Leu Asp Leu Asn Ser
100 105 110
Ile His Asn Arg Asn Pro Ser Pro Lys Gly Gln Ala Ile Tyr Pro Val
115 120 125
Lys Ala Pro Gly Asp Ala Arg Tyr Ser Val Ala Glu Asn Ala Leu Arg
130 135 140
Ala Ala Ile His Ile Pro Ala Ser Phe Gly Tyr Gly Lys Asn Gly Lys
145 150 155 160
Lys Pro Val Ile Leu Val Pro Gly Thr Ala Thr Pro Ala Gly Thr Thr
165 170 175
Tyr Tyr Phe Asn Phe Gly Lys Leu Gly Ser Ala Ala Asp Ala Asp Val
180 185 190
Val Trp Leu Asn Ile Pro Gln Ala Ser Leu Asn Asp Val Gln Ile Asn
195 200 205
Ser Glu Tyr Val Ala Tyr Ala Ile Asn Tyr Ile Ser Ala Ile Ser Glu
210 215 220
Ser Asn Val Ala Val Leu Ser Trp Ser Gln Gly Gly Leu Asp Thr Gln
225 230 235 240
Trp Ala Leu Lys Tyr Trp Pro Ser Thr Arg Lys Val Val Asp Asp Phe
245 250 255
Ile Ala Ile Ser Pro Asp Phe His Gly Thr Val Leu Ala Gly Pro Leu
260 265 270
Asp Ala Leu Ala Val Ser Ala Pro Ser Leu Trp Gln Gln Gly Trp Asn
275 280 285
Thr Glu Phe Ile Arg Thr Leu Arg Gly Gly Gly Gly Asp Ser Ala Tyr
290 295 300
Val Pro Thr Thr Thr Ile Tyr Ser Thr Phe Asp Glu Ile Val Gln Pro
305 310 315 320
Met Ser Gly Ser Gln Ala Ser Ala Ile Leu Ser Asp Ser Arg Ala Val
325 330 335
Gly Val Ser Asn Asn His Leu Gln Thr Ile Cys Gly Gly Lys Pro Ala
340 345 350
Gly Gly Val Tyr Thr His Glu Gly Val Leu Tyr Asn Pro Leu Ala Trp
355 360 365
Ala Leu Ala Val Asp Ala Leu Ser His Asp Gly Pro Gly Asp Pro Ser
370 375 380
Arg Leu Asp Leu Asp Val Val Cys Gly Arg Val Leu Pro Pro Gln Leu
385 390 395 400
Thr Pro Glu Gln Lys Val Ala Ala Ala Ala Leu Leu Ala Pro Ala Ala
405 410 415
Ala Ala Ile Val Ala Gly Tyr Lys Pro Lys Thr Phe Gly Glu Pro Ala
420 425 430
Ile Ala Ser Tyr Ala His
435
<210>2
<211>1314
<212>DNA
<213>人工序列(Artificial Sequence)
<400>2
gcggtgattc cgcgtggagc ggtgccggtt gccagcgacc tgaccatact gaccgtgatt60
accaccggag ggcaggaaac caccctggac accgatgcga aatctattgc gtctctgatt 120
gcgagcgaga ttgtgagcaa aataggcaag acggaattta gccgtagcac caaagatgca 180
aaatctgtgc aggaagcgtt tgataagatt caaagcattt ttgcggatgg caccccggat 240
tttcttaaaa tgacccgtga aattctgacg gtgggcctta tacccgctga tattcttagc 300
tttctgaatg gctatctgaa tctggatctt aatagcattc ataatcgtaa ccctagcccg 360
aaaggccagg ccatttatcc ggtgaaagcg cctggcgacg cacgttatag cgtagcggag 420
aacgccttac gtgcagctat tcacatcccg gcgagctttg gctatggaaa gaatggcaaa 480
aaaccggtga tcctggttcc ggggaccgcg accccagcgg gcaccaccta ttacttcaat 540
tttggtaaac tgggctcggc tgcagatgcg gacgtggtgt ggttaaacat accgcaggcg 600
tcactgaatg acgtccaaat aaacagcgaa tatgtggcgt atgcgataaa ctatattagc 660
gccatttccg aaagtaacgt ggcagttctg agctggagcc aaggcggcct ggatacccag 720
tgggcgctga aatattggcc gagtacccgt aaagtggtgg atgatttcat agcgattagc 780
ccggacttcc atggtaccgt gctggcaggg ccgctggatg cgctggcggt gagcgcaccc 840
agcctgtggc aacagggctg gaataccgag tttatacgga ccctgcgtgg cggagggggc 900
gacagcgcgt atgtgccgac caccacgatt tattcgacct ttgatgaaat tgtgcaaccg 960
atgtccggct cccaggcgag cgcgattttg tcggattcac gtgcggtggg agttagtaac 1020
aaccatttgc agacaatttg cgggggtaaa cctgctgggg gcgtgtatac ccatgaaggc 1080
gtgctgtata atccgcttgc atgggcactg gcagtggatg ccttaagcca tgatggccca 1140
ggggatccga gccgtctgga tttggatgtg gtttgcggcc gtgttttgcc tccacaactg 1200
actccggaac agaaagtggc ggcagcggcg cttctggctc ctgccgcagc cgcgattgtg 1260
gctggctaca aaccgaaaac cttcggtgaa ccggcgattg ctagttatgc acat 1314
一种表达R构型选择性的脂肪酶的重组菌及其应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0