IPC分类号 : C12N15/87,C12Q1/00,A61K49/00,A61K9/51,A61K47/42,A61K47/30,A61K47/02,A61P35/00
专利摘要
本发明公开了一种磁性复合纳米颗粒及其制备方法和应用,该磁性复合纳米颗粒粒径均一,直径40‑60nm,表面通过亲和素‑生物素连接的含脱碱基位点DNA双链可被目标蛋白脱碱基核酸内切酶I(APE1)特异性地识别和切割,释放出荧光基团或药物分子;同时,本发明所获得的磁性复合纳米颗粒具有良好的分散性、稳定性和生物相容性,从而可用于活细胞内APE1的原位荧光成像。另外由于癌细胞通常过表达APE1,上述磁性复合纳米颗粒可以在癌细胞内更有效地释放药物,有望实现针对癌细胞的精准治疗。
权利要求
1.一种磁性复合纳米颗粒,由内向外依次包括磁核、二氧化硅壳层和生物分子修饰层,所述磁核为铁磁性纳米颗粒,所述二氧化硅壳层为表面修饰有羧基的二氧化硅,所述生物分子修饰层为亲和素及与之结合的生物素化的含有脱碱基空位的双链DNA。
2.如权利要求1所述的磁性复合纳米颗粒,其特征在于,所述铁磁性纳米颗粒为四氧化三铁纳米颗粒或γ-三氧化二铁纳米颗粒。
3.如权利要求1所述的磁性复合纳米颗粒,其特征在于,所述磁性复合纳米颗粒的TEM粒径为40-60nm,其DLS粒径为65-75nm。
4.如权利要求1所述的磁性复合纳米颗粒,其特征在于,所述磁性复合纳米颗粒的表达式为Fe3O4@SiO2@AVD-AP-DNA或γ-Fe2O3@SiO2@AVD-AP-DNA,其中Fe3O4代表四氧化三铁磁核,γ-Fe2O3则代表γ-三氧化二铁磁核;SiO2代表二氧化硅壳层;AVD代表亲和素层;AP-DNA代表生物素化的含有脱碱基空位的双链DNA层。
5.如权利要求1所述的磁性复合纳米颗粒,其特征在于,所述生物素化的含有脱碱基空位的双链DNA的两条单链的序列分别为:
5’-GGGGACGACTCCATCGACCTCAAGCAGTTGATCCTTTGGAAAAAAA-Biotin-3’和5’-GTCGATGGAGXCGTCCCC-FAM-3’,其中X表示脱碱基位点,Biotin表示生物素标记,FAM为羧基荧光素标记。
6.权利要求1-5任意一项所述的磁性复合纳米颗粒的制备方法,包括:先在二氧化硅壳层的外层共价连接上亲和素,然后通过亲和素与生物素的强亲和作用,将生物素化的含U碱基的双链DNA修饰在二氧化硅包覆的铁磁性纳米颗粒表面,最后再利用UDG酶将U碱基切除,产生含脱碱基空位的双链DNA。
7.如权利要求6所述的制备方法,其特征在于,具体步骤如下:
1)将羧基修饰的二氧化硅壳层包覆的铁磁性纳米颗粒超声分散在纯水中,分别加入EDC和NHS,室温下震荡反应,作为溶液A;
2)在溶液A中加入亲和素,室温下震荡反应,磁分离洗涤除去未反应的物质,然后将得到的反应物重新超声分散在纯水中,作为溶液B;
3)在溶液B中加入生物素化的含U碱基的双链DNA,室温下孵育30-90分钟,磁分离并洗涤,除去未反应的物质,然后将得到的含U碱基的双链DNA修饰的磁性纳米颗粒重新超声分散在PBS溶液中,作为溶液C;
4)将溶液C加入到buffer 1.1缓冲溶液中,加入UDG酶切除DNA双链中的U碱基,得到磁性复合纳米颗粒。
8.如权利要求7所述的制备方法,其特征在于,步骤1)中,羧基修饰的二氧化硅壳层包覆的铁磁性纳米颗粒超声分散在纯水中的终浓度为0.5-2mg/mL;EDC的浓度为0.5-2mg/mL,NHS的浓度为1-5mg/mL,EDC、NHS与羧基修饰的二氧化硅壳层包覆的铁磁性纳米颗粒的重量比为4:10:1。
9.如权利要求7所述的制备方法,其特征在于,步骤2)中亲和素的浓度为0.1-0.2mg/mL,加入亲和素使纳米颗粒与亲和素在混合溶液中终浓度的比为5:1,室温下震荡反应8-12个小时;步骤3)中,加入的生物素化的含U碱基的双链DNA在溶液B中的终浓度为0.2-1μM;步骤4)中,加入的UDG酶在包含溶液C的buffer 1.1缓冲溶液中的终浓度1.0-100U/mL,反应时间范围是0.5-10min。
10.权利要求1-5任意一项所述的磁性复合纳米颗粒在体外酶活性测定、活细胞内核酸修复酶的原位成像中的应用。
说明书
技术领域
本发明涉及一种多功能复合纳米颗粒及其制备方法和应用。更具体地说,涉及一种亲和素修饰的核酸功能化磁性复合纳米颗粒及其制备方法和应用。该纳米颗粒可用作基因载体、活细胞内核酸修复酶的原位成像和药物载体,属于纳米颗粒制备技术领域。
背景技术
纳米材料具有优良的电学、光学、力学性能,形貌可控且表面易修饰。生物分子具有特异性强、结合位点丰富等特点(Eugenii Katz,Itamar Willner.Integrated Nanoparticle-Biomolecule Hybrid Systems:Synthesis,Properties,and Applications.Angew.Chem.Int.Ed(2004),43,6042–6108)。随着纳米技术和生物技术的蓬勃发展,将纳米材料与生物分子相结合制成各种各样的复合纳米材料,可用来对生物体进行诊断、治疗、修复或替换其病损组织,并在细胞成像、生物传感等方面展现出良好的应用前景。
亲和素与生物素之间的结合作用是目前发现的生物分子间最牢固的结合体系(Buller,HR.,Gallus,AS.,Pillion,G.,Prins,MH.,Raskob,GE.Enoxaparin followed by once-weekly idrabiotaparinux versus enoxaparin plus warfarin for patients with acute symptomaticpulmonary embolism:a randomised,double-blind,double-dummy,non-inferiority trial.Lancet(2012),379,123–129),可以抵抗有机溶剂、表面活性剂、蛋白水解酶、极端的温度和pH的影响等(Green,N.Michael.Avidin.Advances in Protein Chemistry Volume(1975),29,85-133)。将亲和素与修饰了羧基的硅纳米颗粒共价连接,然后将生物素化的DNA通过亲和素与生物素之间的亲和作用修饰到共价连接了亲和素的硅纳米颗粒表面,可以大大提高纳米颗粒表面DNA的数量,并且增强了DNA与纳米载体的牢固性。
DNA或药物转导是指借助外源介导作用将DNA或药物导入到癌细胞或靶细胞中。目前病毒载体虽可以达到较高的转染效率,但存在强免疫原性、高致突变风险、小容量等缺点,限制了其在生物及临床治疗中的应用。而非病毒载体,尤其是纳米颗粒不仅可以克服以上缺点,并且具有合成简便、重复性高、多种物理化学性质和易表面修饰等优点,实现纳米载体的多功能化。
磁纳米颗粒不仅易修饰,还具有磁场效应和荧光猝灭效应,将磁纳米颗粒将其他颗粒相结合并修饰上生物分子,便可以解决纳米颗粒分离时间长和转染时间长的问题(Liu,YB.,Fang,SM.,Zhai,JQ.,Zhao,MP.Construction of antibody-like nanoparticles for selective protein sequestration in living cells.NANOSCALE(2015),7(16):7162-7167)。硅纳米颗粒不仅具有生物相容性好、多孔性,易反应的优点,还可以保护修饰在纳米颗粒表面的DNA不受DNase I酶的干扰(Roy,I.,Ohulchanskyy,TY.,Bharali,DJ.,Pudavar,HE.,Mistretta,RA.,Kaur,N.,Prasad,PN.Opticaltracking oforganically modifiedsilica nanoparticles as DNA carriers:A nonviral,nanomedicine approachfor gene delivery.PNAS(2005),102(2):279-284),因此将磁纳米颗粒与硅纳米颗粒相结合,不仅实现了快速高效的转染效率,减少了生物毒性,还保护了被修饰的DNA能够完整的被转染到细胞中。
目前已经有的利用硅纳米颗粒将DNA导入细胞的方法,有共价连接DNA(Cai L,Chen Z Z,Chen M Y,et al.MUC-1aptamer-conjugated dye-doped silica nanoparticlesforMCF-7cells detection[J].Biomaterials,2013,34(2):371-381.)和利用静电相互作用连接(Qian R,Ding L,Ju H.Switchablefluorescent imaging of intracellular telomerase activity using telomerase-responsive mesoporous silica nanoparticle.Journal of the American Chemical Society,2013,135(36):13282-13285.)等方法。此类方法主要用于与细胞内miRNA或mRNA的杂交(Zhang P,Cheng F,Zhou R,et al.DNA‐hybrid‐gated multifunctional mesoporous silica nanocarriers for dual‐targeted and microRNA‐responsive controlled drug delivery.Angewandte Chemie International Edition,2014,53(9):2371-2375.),由于硅纳米颗粒对DNA的保护作用(He X,Wang K,Tan W,et al.Bioconjugated nanoparticles for DNA protection from cleavage.Journal of the American Chemical Society,2003,125(24):7168-7169.),这些纳米颗粒通常都抑制了DNA与细胞内核酸酶的反应,从而难以用于核酸酶的活性分析和原位成像。另外,目前利用纳米颗粒导入miRNA药物,缺乏针对癌细胞特异性的释放调控作用(Mura S,Nicolas J,Couvreur P.Stimuli-responsive nanocarriersfor drug delivery.Nature materials,2013,12(11):991-1003.)。
发明内容
本发明的目的是提供一种磁性复合纳米颗粒的制备方法和应用。该磁性复合纳米颗粒不仅可以在体外对溶液中的目标蛋白进行特异性的识别和定量分析,更为重要的是,可以在磁场作用下快速地进入活细胞,对其中的目标蛋白进行原位的荧光成像,通过荧光显微镜对其在细胞中的分布进行示踪。若将荧光集团替换为抗癌药物,还可以实现对癌症进行针对性治疗。
为了实现上述目的,本发明采用以下技术方案。
一种磁性复合纳米颗粒,由内向外依次包括磁核、二氧化硅壳层和生物分子修饰层,所述磁核为铁磁性纳米颗粒,所述二氧化硅壳层为表面修饰有羧基的二氧化硅,所述生物分子修饰层为亲和素及与之(即亲和素)结合的生物素化的含有脱碱基空位的双链DNA(biotinylated-AP-DNA)。
进一步地,所述铁磁性纳米颗粒为四氧化三铁纳米颗粒或γ-三氧化二铁纳米颗粒。
进一步地,所述磁性复合纳米颗粒的TEM粒径为40-60nm,其DLS粒径为65-75nm。
进一步地,所述磁核的直径为20-30nm,所述二氧化硅壳层的厚度为10-15nm,所述生物分子修饰层的厚度小于或等于20nm。
进一步地,所述磁性复合纳米颗粒的表达式为Fe3O4@SiO2@AVD-AP-DNA或γ-Fe2O3@SiO2@AVD-AP-DNA。其中Fe3O4代表四氧化三铁磁核,γ-Fe2O3则代表γ-三氧化二铁磁核;SiO2代表二氧化硅壳层;AVD代表亲和素层;AP-DNA代表生物素化的含有脱碱基空位的双链DNA(biotinylated-AP-DNA)层。
进一步地,所述生物素化的含有脱碱基空位的双链DNA(biotinylated-AP-DNA)的两条单链的序列分别为:
5’-GGGGACGACTCCATCGACCTCAAGCAGTTGATCCTTTGGAAAAAAA-Biotin-3’和5’-GTCGATGGAGXCGTCCCC-FAM-3’,其中X表示脱碱基位点,Biotin表示生物素标记,FAM为羧基荧光素标记。
本发明还提供了上述磁性复合纳米颗粒的制备方法,包括:先在二氧化硅壳层的外层共价连接上亲和素,然后通过亲和素与生物素的强亲和作用,将生物素化的含U碱基的双链DNA(dsDNA)修饰在二氧化硅包覆的铁磁性纳米颗粒表面,最后再利用UDG酶将U碱基切除,产生含脱碱基空位的双链DNA(AP-DNA)。
进一步地,上述制备方法的具体步骤如下:
1)将羧基修饰的二氧化硅壳层包覆的铁磁性纳米颗粒超声分散在纯水中,分别加入EDC和NHS,室温(以下均指15-28℃)下震荡反应,作为溶液A。
2)在溶液A中加入亲和素,室温下震荡反应。磁分离洗涤除去未反应的物质,然后将得到的反应物重新超声分散在纯水中,作为溶液B。
3)在溶液B中加入生物素化的含U碱基的双链DNA,室温下孵育30-90分钟。磁分离并洗涤,除去未反应的物质,然后将得到的含U碱基的双链DNA修饰的磁性纳米颗粒重新超声分散在PBS溶液中,作为溶液C。
4)将溶液C加入到buffer 1.1缓冲溶液中,加入UDG酶切除DNA双链中的U碱基,得到磁性复合纳米颗粒。
进一步地,步骤1)中,羧基修饰的二氧化硅壳层包覆的铁磁性纳米颗粒超声分散在纯水中的终浓度为0.5-2mg/mL。
进一步地,步骤1)中超声时间需超过10分钟。
进一步地,步骤1)中EDC的浓度为0.5-2mg/mL,NHS的浓度为1-5mg/mL,EDC、NHS与羧基修饰的二氧化硅壳层包覆的铁磁性纳米颗粒的重量比为4:10:1。
进一步地,为使二氧化硅壳层表面的羧基充分活化,EDC和NHS要加入略过量,活化时间不要过短或过长,根据室温的不同,优选活化时间为15-45分钟。
进一步地,步骤2)中亲和素的浓度为0.1-0.2mg/mL,优选0.1mg/mL。加入亲和素使纳米颗粒与亲和素在混合溶液中终浓度的(重量)比为5:1,室温下震荡反应8-12个小时,超声分散时间为5分钟。
其中,在二氧化硅层外共价连接亲和素时,为使纳米颗粒充分分散,纳米颗粒的浓度不要过高,优选浓度为0.5-1mg/mL。
步骤2)反应结束后,为了除去反应体系中的未反应物,可以用去离子水洗1-3遍,然后再超声分散在纯水中。
进一步地,步骤3)中,在将生物素化的含U碱基的双链DNA(dsDNA)修饰到纳米颗粒表面上时,为使dsDNA的构象更稳定一致,首先将其进行升温退火(95℃下孵育90s,75℃下孵育90s,50℃下孵育90s,最后在37℃下孵育600s),然后将dsDNA加入到溶液B中。
进一步地,步骤3)中,加入的生物素化的含U碱基的双链DNA在溶液B中的终浓度为0.2-1μM。
为使dsDNA连接到纳米颗粒表面的数量最多,可优化其浓度,使最终浓度为1μM。
进一步地,步骤3)中,将得到的含U碱基的双链DNA修饰的磁性纳米颗粒重新超声分散在0.1M的PBS溶液中,超声分散时间为5分钟,如不立即使用,则应置于4℃保存。
进一步地,步骤4)中,buffer 1.1缓冲溶液的组成为:10mM Bis Tris Propane-HCl,10mM MgCl2,100μg/ml BSA,pH 7.0(25℃)。
加入的UDG酶在包含溶液C的buffer 1.1缓冲溶液中的终浓度1.0-100U/mL,反应时间范围是0.5-10min。
本发明还提供了上述磁性复合纳米颗粒在体外酶活性测定、活细胞内核酸修复酶的原位成像中的应用。
本发明的有益效果为:
四氧化三铁或γ-三氧化二铁磁核作为复合颗粒的内核,其特点是:对一些荧光基团具有猝灭作用、有助于在颗粒制备过程中对颗粒进行分离、洗涤、而且在导入细胞时,可以借助外加磁场的作用加速纳米粒子进入细胞的过程。表面修饰有羧基的二氧化硅层能够提高纳米颗粒的亲水性和生物相容性,提供羧基与亲和素发生共价连接反应,并保证当荧光团远离颗粒表面时能够释放荧光。亲和素(AVD)与biontinylated-ds DNA上的biotin有强亲和作用,这种作用可以将ds DNA拉近到纳米颗粒表面,使ds DNA能够成功并有效的修饰在纳米颗粒上。最为重要的是,我们在研究中发现并确证,AVD与脱碱基核酸内切酶I(APE1)之间存在特异性的亲和作用,这种相互作用可以使AVD将溶液中的APE1吸引到纳米颗粒表面,作用于DNA上的脱碱基位点,有效切割脱碱基位点5’侧的磷酸二酯键,从而释放连接在DNA上的荧光基团或药物。DNA在这里作为纳米载体的分子臂,不仅可连接荧光基团用于对APE1进行荧光检测或细胞内成像,还可以连接药物分子,并能保证只有在APE1存在的情况下才释放出荧光基团或药物分子等,从而保证了复合纳米颗粒在可以在APE1表达过量的癌细胞当中有效发挥作用,而减少甚至避免对正常细胞的副作用。
本发明合成了一种磁性多功能复合纳米颗粒,粒径均一,直径40-60nm,表面连接的含脱碱基位点DNA双链可被目标蛋白脱碱基核酸内切酶I(APE1)特异性地识别和切割,释放出荧光基团或药物分子。所获得的纳米颗粒具有良好的分散性、稳定性和生物相容性,从而可用于活细胞内APE1的原位荧光成像。另外由于癌细胞通常过表达APE1,上述纳米颗粒可以在癌细胞内更有效地释放药物,有望实现针对癌细胞的精准治疗。
附图说明
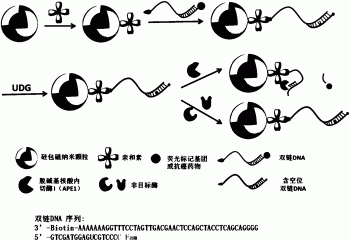
图1为磁性复合纳米颗粒的制备过程及原理示意图。
图2为纳米探针A(Fe3O4@SiO2@AVD-AP-DNA纳米颗粒)的透射电镜图。
图3为MNPs(Fe3O4@SiO2),MNP@AVD(Fe3O4@SiO2@AVD)和纳米探针A(Fe3O4@SiO2@AVD-AP-DNA)三种颗粒在0.1mg/mL水溶液中的zeta电势。
图4a为纳米探针A对不同浓度APE1响应的时间曲线;图4b为纳米探针A检测APE1活性的线性拟合曲线。
图5为纳米探针A对各种常见核酸酶的选择性。
图6为纳米探针A磁转染30分钟到HeLa细胞中后随时间变化的荧光图。
图7为细胞内对照探针的荧光图及在不同药物作用下细胞内荧光信号的变化图。
图8为纳米探针A对细胞的毒性。
具体实施方式
下面结合附图和具体实施方式对本发明做详细说明。以下具体实施方式将有助于理解发明,但并不限制本发明的内容。
实施例1、制备磁性复合纳米颗粒Fe3O4@SiO2@AVD-AP-DNA(纳米探针A)
本发明制备磁性复合纳米颗粒的的过程如图1所示,具体包括以下步骤:
将1.0mg Fe3O4@SiO2在室温,40KHz下(本发明中均采用该超声频率,根据需要调整为不同的超声时间)超声20分钟,分散在2.0mL纯水中配成0.5mg/mL的溶液,加入4.0mg EDC和10.0mg NHS活化羧基,室温下震荡反应30分钟。加入0.1mL浓度为2.0mg/mL的亲和素,室温下振荡反应8个小时。磁分离,除去未反应的物质,用去离子水洗三次,重新超声分散在2.0mL纯水中。加入终浓度为1μM的生物素化的含U碱基的双链DNA,室温下孵育1小时。磁分离,用PBS(pH 7.4,0.1M)洗三次除去未反应的DNA,将得到的含U碱基的双链DNA修饰的磁性纳米颗粒重新超声分散在2.0mL0.1M PBS(pH 7.4)中继续使用或保存于4℃。在50μLPCR管中,加入5μL 1.0mg/mL上述分散在0.1M PBS中含U碱基的双链DNA修饰的磁性纳米颗粒溶液,5μL10×Buffer1.1缓冲液,补加去离子水使得总体积为47μL,然后加入1μL 500U/mL的UDG酶,反应2min,得到多功能复合纳米颗粒Fe3O4@SiO2@AVD-AP-DNA(纳米探针A),立即用于APE1的活性测定或导入细胞实验。
通过透射电子显微镜表征复合纳米颗粒Fe3O4@SiO2@AVD-AP-DNA如图2所示,可见复合纳米颗粒大小均一,分散性好,其粒径在60nm左右。从原纳米颗粒Fe3O4@SiO2(MNPs),中间体Fe3O4@SiO2@AVD(MNP@AVD)和复合纳米颗粒Fe3O4@SiO2@AVD-AP-DNA(纳米探针A)的zeta电势值可知(图3),原纳米颗粒成功连接上AVD和biotinylated-AP-DNA。
实施例2、对溶液中的APE1活性直接进行检测
在该实施例中,设计的DNA探针序列如下:
5’-GGGGACGACTCCATCGACCTCAAGCAGTTGATCCTTTGGAAAAAAA-Biotin-3’
5’-GTCGATGGAGXCGTCCCC-FAM-3’
其中X表示脱碱基位点,Biotin表示生物素标记,FAM为羧基羧基荧光素标记。
实验步骤如下:
1.在200μL PCR管中,加入10μL 0.5mg/mL实施例1制备得到的磁性复合纳米颗粒的溶液,5μL 10×Buffer1.1缓冲液,补加去离子水使得总体积为48μL,然后加入2μL不同浓度的APE1溶液,使APE1的终浓度分别为0,0.01,0.05,0.1,0.2,0.5,1U/mL,检测复合纳米颗粒的响应。
采用Stratagene Mx3000P荧光PCR仪,37℃下每5s采集荧光,激发波长为470nm,在510nm下测发射信号,并拟合反应初始50s内荧光上升速率与APE1浓度的工作曲线。
检测结果如图4a所示,拟合结果如图4b所示,复合纳米颗粒可以检测到0.01U/mL的APE1,具有灵敏的响应。随着APE1浓度的增加,其荧光上升速率与APE1浓度呈线性关系,R2=0.996,工作范围是0.01-1.0U/mL。
2.在200μLPCR管中,加入10μL 0.5mg/mL实施例1制备得到的磁性复合纳米颗粒的溶液,5μL 10×DNase I缓冲液,补加去离子水使得总体积为48μL,加入2μL 125U/mL DNase I溶液,使DNase I的终浓度为5U/mL,检测复合纳米颗粒的响应。
采用Stratagene Mx3000P荧光PCR仪,37℃下每5s采集荧光,激发波长为470nm,在510nm下测发射信号。磁性复合纳米颗粒对其它酶的响应检测过程与此相同,只是将缓冲液替换为其最合适的条件。
检测结果如图5所示,各种酶测定的终浓度分别为APE1:2.0U/mL;DNase I:5.0U/mL;Exo III:4.0U/mL;Lambda exo:66.7U/mL;Exo I:12.5U/mL;T5:5U/mL;T7 50U/mL)。可以发现复合纳米颗粒在APE1的存在下,AP-DNA中的脱碱基位点可以被切割从而释放出远端带有FAM的核苷酸,使得荧光上升速率较快,而对其他的酶,特别是DNase I等则响应很慢。说明复合纳米颗粒对APE1具有很好的选择性。值得说明的是,Exo III是由细菌表达的、同时具有3’外切活性和脱碱基位点内切活性的核酸酶,从图5中也可以看到磁性复合纳米颗粒对其有一定的响应。
实施例3、复合纳米颗粒在磁场作用下快速导入细胞并释放荧光信号
制备得到的磁性复合纳米颗粒具有较好的稳定性、生物相容性,在磁场作用下通过细胞内吞作用可以快速导入Hela细胞并对APE1进行成像。
实验步骤如下:
1.在含有1%青霉素-链霉素双抗和10%失活胎牛血清的DMEM培养基中培养细胞,培养箱条件为37℃以及5%CO2/95%空气。当细胞长至覆盖培养瓶的70%-80%时,加入0.25%的胰酶在37℃下处理4min然后将细胞转移96孔平底玻璃板上,每个孔含有0.1mL细胞培养液,约有104个细胞。在实验前将细胞培养24h使得其贴壁。
2.用DPBS缓冲液对细胞进行洗涤,然后加入实施例1制备得到的磁性复合纳米颗粒的溶液,使其终浓度为50μg/mL。将96孔板置于Chemicell公司的MagnetoFACTOR-96磁板上,在37℃以及5%CO2/95%空气的培养箱中放置30min。移去磁板后,吸走96孔板中的溶液,用DPBS缓冲液洗涤细胞5次,充分洗去没有进入细胞的磁纳米颗粒。
3.在导入磁性复合纳米颗粒的细胞中加入含有无色DMEM培养基,在37℃以及5%CO2/95%的在线培养装置中培养,采用配备Evolve-EMCCD的Olympus IX 71荧光显微镜以及100倍物镜下拍摄细胞,用相应的荧光光栅拍摄对应不同探针的荧光图片(曝光时间10ms,发射增益值EM gain为100)。用ImageJ软件进行结果处理,如图6所示。随着磁转染结束后孵育时间的增加,HeLa细胞中的(绿色)荧光分布的区域增加,荧光强度也增加,在120分钟处达到最大。180分钟后荧光分布区域和荧光强度逐渐减少。说明纳米探针A进入到了HeLa细胞中。
4.为进一步证明细胞内产生的荧光信号确实来自细胞内APE1对磁性复合纳米颗粒上DNA序列中脱碱基位点的定点切割,我们将未经UDG酶处理的含U碱基的双链DNA修饰的磁性纳米颗粒直接导入细胞进行对照实验。另外,还选择了两种药物对细胞进行处理,其中叔丁基过氧化氢(TBHP)为APE1酶激活剂,7-硝基吲哚-2-羧酸(NCA)为APE1酶活性抑制剂,观察在药物作用下细胞内酶活性的变化情况。从图7可以看到,不经UDG酶处理,直接将含U碱基的双链DNA修饰的磁性纳米颗粒导入细胞,经过120min后仍未出现荧光信号。而将含脱碱基位点的纳米探针A导入细胞后,经过同样时间看到了明显的荧光信号。表明本发明所制备的磁性复合纳米颗粒在细胞内也具有良好的选择性。另外,从图7还可以看到,用NCA抑制剂处理后的细胞,在导入纳米探针A后几乎看不到荧光信号,而用TBHP处理过的细胞,荧光信号明显增强,且随着TBHP加入量的增加,荧光信号进一步增强。上述结果进一步证实,细胞内出现的荧光信号是由APE1酶对于磁性复合纳米颗粒中的DNA脱碱基位点产生了特异性切割作用后产生的。
实施例4、磁性复合纳米颗粒的细胞毒性研究
将终浓度为25-100μg/mL的纳米探针A对HeLa细胞进行磁转染实验,孵育120分钟。然后加入CCK-8试剂孵育1小时,将不加入纳米探针的组作为对照组,将既不加入纳米探针也不进行DPBS缓冲液洗涤操作的组作为空白组。在450nm下检测培养液中的紫外吸收,然后计算细胞的活性。从图8中可以看出,当纳米探针的浓度为100μg/mL时,仍有80%的细胞保持活性。证明了此复合纳米颗粒即纳米探针A的低毒性。
一种磁性复合纳米颗粒及其制备方法和应用专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0