专利摘要
本发明公开了一种用于微控芯片的单向球阀,包括进样系统、微腔、第一分叉流道、第二分叉流道以及通用芯片区,所述进样系统连接微腔,微腔的另一端连接第一分叉流道和第二分叉流道,后两者向前延伸重新聚合后与通用芯片区连接。本发明还提供了所述单向球阀的制备方法。相对于现有技术,本发明实现了原位合成与移除球阀阀芯的便捷操作,增加了微流控芯片配件的便携性和可操作性;且能满足“即时检测”的要求,拓展了微流控芯片的使用范围。
权利要求
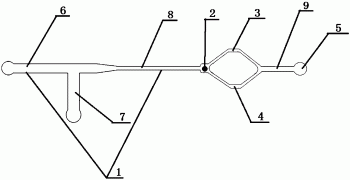
1.一种用于微控芯片的单向球阀,其特征在于,包括进样系统(1)、微腔(2)、第一分叉流道(3)、第二分叉流道(4)以及通用芯片区(5),所述进样系统(1)连接微腔(2),微腔(2)的另一端连接第一分叉流道(3)和第二分叉流道(4),后两者向前延伸重新聚合后与通用芯片区(5)连接;
所述微腔(2)中具有利用温控相变材料制成的阀芯,所述阀芯能够高温液态添加,低温固态放置,且能高温液态移除。
2.根据权利要求1所述的单向球阀,其特征在于,所述温控相变材料为琼脂糖、长链烷烃、丁二胺、硬脂酸丁酯或石蜡。
3.根据权利要求1所述的单向球阀,其特征在于,所述微腔(2)的宽度为1125μm,深度为600μm。
4.根据权利要求1所述的单向球阀,其特征在于,所述进样系统(1)包括第一进样流道(6)、第二进样流道(7)和窄流道(8);所述第一进样流道(6)和第二进样流道(7)呈“T”型交汇,交汇点向前延伸与窄流道(8)相连通,窄流道(8)与微腔(2)中部的小孔相通;第一分叉流道(3)和第二分叉流道(4)的重新聚合点与通用芯片区(5)之间还连接有后续流道(9)。
5.根据权利要求4所述的单向球阀,其特征在于,所述第一进样流道(1)和第二进样流道(2)宽度均为600μm,深度均为200μm;所述第一分叉流道(4)和第二分叉流道(5)的宽度均为200μm,深度均为600μm。
6.根据权利要求1所述的单向球阀,其特征在于,所述单向球阀是由硅、玻璃、石英、聚二甲基硅丙烷或聚甲基丙烯酸甲酯制成。
7.权利要求1-6任一项所述单向球阀的制备方法,其特征在于,包括如下步骤:
(1)在制备材料上利用快速光刻法制得具有两种不同高度的胶芯片阳模,然后通过倒模法分别制得芯片顶板与底板,其中顶板流道与底板流道镜像对称;
(2)在显微镜下将芯片顶板与底板对齐,通过两步固化法键合,即可得到完整微控芯片;
(3)在上述微控芯片的微腔中原位合成能够高温液态添加,低温固态放置,且能高温液态移除的阀芯,即得。
8.根据权利要求7所述的单向球阀的制备方法,其特征在于,所述步骤(3)中原位合成的方法包括以下步骤:
(1)通过进样系统注入油相溶液和水相溶液,并且利用驱动装置驱动溶液进入微腔,待液滴产生后,立刻停止注入水相溶液,待液滴呈长条状时,然后缓慢进入微腔中,呈球形;
(2)利用驱动装置将注入水相溶液的流道调至抽取模式,待流道内的水相溶液全部排出后,将芯片冷藏,使微腔中的液滴固化。
9.根据权利要求8所述的单向球阀的制备方法,其特征在于,所述水相溶液为琼脂糖水溶液,所述油相溶液为植物油、矿物油、山梨糖醇酐油酸酯、吐温80、聚乙二醇辛基苯基醚中的一种或几种的混合物。
10.根据权利要求9所述的单向球阀的制备方法,其特征在于,所述水相溶液为3%的琼脂糖水溶液,所述油相溶液为矿物油、山梨糖醇酐油酸酯、吐温80和聚乙二醇辛基苯基醚的混合物,重量比为矿物油:山梨糖醇酐油酸酯:吐温80:聚乙二醇辛基苯基醚=95%:4.5%:0.45%:0.05%。
说明书
技术领域
本发明涉及一种用于微控芯片的单向球阀及其制备方法,属于微控芯片领域。
背景技术
随着医疗技术不断发展,许多功能强大的医疗检测仪器不断涌现。但在极度欠发达地区以及野外环境中,由于电力供应以及专业医疗人员的匮乏,基于这些大型医疗仪器的疾病检测往往难以开展,人们亟需开发一种便于携带且无需专业人员操作的即时检测(point-of-care)仪器。微流控芯片体积微小、操作简单、节省试剂、检测效率高且成本低廉,很好的满足了即时检测的需求,具有广泛应用前景。
现有的微流控芯片的进样流道,一般都是双向导通的直道,常通过微量注射泵驱动注射器,或者通过精密压力泵来驱动反应试剂进入芯片微流道。相比于微流控芯片本身,微量注射泵与精密压力泵价格昂贵,且体积较大、不便于携带,极大限制了微流控技术在实验室外的普及与应用。目前,也有多种微泵系统可以实现进样,如气动薄膜泵、压电泵、基于电磁铁与永磁体间磁力挤压薄膜实现液体驱动的磁力泵,以及通过气体受热膨胀挤压薄膜实现液体驱动的热力气动泵等诸多微泵形式。但应用这些进样方式均涉及到在普通微流控芯片中加工多层流道或集成复杂器件的问题,如气动泵需要在液体流道上加工气动流道,而压电泵或磁力泵则需要在芯片中加工底座以固定压电材料或磁性材料等。已有的阀控装置,也无法做到将阀控元件原位合成和移除,仍须依靠单独组装和拆卸来实现装置的功能。这些复杂的微加工工艺不仅提高了微流控芯片的加工成本与耗时,同时也使得普通实验室无法独立完成这些芯片的加工,限制了微流控系统的普及范围与普及速度。此外,微流控芯片的进样效果很大程度上依赖于这些微泵系统,一旦辅助进样的微泵中的薄膜等部件因长期使用等原因发生损坏,由于这些部件都封装在芯片当中,难以修补与更换,很容易导致整个微流控芯片无法继续使用。
因此,微控芯片现有技术中,微泵系统器件复杂,无法原位合成和移除,难以修补和更换,限制了微流控芯片的室外应用。
发明内容
发明目的:为了解决上述技术问题,本发明提供了一种用于微控芯片的单向球阀及其制备方法。
技术方案:为实现上述目的,本发明提供了一种用于微控芯片的单向球阀,包括进样系统、微腔、第一分叉流道、第二分叉流道以及通用芯片区,所述进样系统连接微腔,微腔的另一端连接第一分叉流道和第二分叉流道,后两者向前延伸重新聚合后与通用芯片区连接;
所述微腔中具有利用温控相变材料制成的阀芯,所述阀芯能够高温液态添加,低温固态放置,且能高温液态移除。
作为优选,所述温控相变材料为琼脂糖、长链烷烃、丁二胺、硬脂酸丁酯或石蜡。
作为另一种优选,所述微腔的宽度为1125μm,深度为600μm。
作为另一种优选,所述进样系统包括第一进样流道、第二进样流道和窄流道;所述第一进样流道和第二进样流道呈“T”型交汇,交汇点向前延伸与窄流道相连通,窄流道与微腔中部的小孔相通;第一分叉流道和第二分叉流道的重新聚合点与通用芯片区之间还连接有后续流道。
作为进一步优选,所述第一进样流道和第二进样流道宽度均为600μm,深度均为200μm;所述第一分叉流道和第二分叉流道的宽度均为200μm,深度均为600μm。
作为另一种优选,所述单向球阀是由硅、玻璃、石英、聚二甲基硅丙烷或聚甲基丙烯酸甲酯制成。
本发明还提供了所述单向球阀的制备方法,包括如下步骤:
(1)在制备材料上利用快速光刻法制得具有两种不同高度的胶芯片阳模,然后通过倒模法分别制得芯片顶板与底板,其中顶板流道与底板流道镜像对称;
(2)在显微镜下将芯片顶板与底板对齐,通过两步固化法键合,即可得到完整微控芯片;
(3)在上述微控芯片的微腔中原位合成能够高温液态添加,低温固态放置,且能高温液态移除的阀芯,即得。
作为优选,所述步骤(3)中原位合成的方法包括以下步骤:
(1)通过进样系统注入油相溶液和水相溶液,并且利用驱动装置驱动溶液进入微腔,待液滴产生后,立刻停止注入水相溶液,待液滴呈长条状时,然后缓慢进入微腔中,呈球形;
(2)利用驱动装置将注入水相溶液的流道调至抽取模式,待流道内的水相溶液全部排出后,将芯片冷藏,使微腔中的液滴固化。
作为进一步优选,所述水相溶液为琼脂糖水溶液,所述油相溶液为植物油、矿物油、山梨糖醇酐油酸酯(Span 80)、吐温80(Tween 80)、聚乙二醇辛基苯基醚(Triton X-100)中的一种或几种的混合物。
所述琼脂糖水溶液的浓度,只要能稳定实现其功能均可,最优选为3%;所述琼脂糖凝胶可以是常规熔点琼脂糖,也可以低熔点琼脂糖。凝胶微球的组成,可以完全由琼脂糖为溶质组成的凝胶,也可以是以琼脂糖为主要溶质的凝胶微球。
所述油相溶液优选为矿物油、山梨糖醇酐油酸酯、吐温80和聚乙二醇辛基苯基醚的混合物,重量比为矿物油:山梨糖醇酐油酸酯:吐温80:聚乙二醇辛基苯基醚=95%:4.5%:0.45%:0.05%。
在一些实际应用中,通用芯片区流道设计十分复杂,从而降低微泵的进样效率。这时,为保证每次泵液过程中多数液体可进入通用芯片区,可在T型结构左侧再增加一个或多个单向球阀结构。这样一来,在灌注过程中,该球阀关闭,液体无法流向T型结构左侧,从而显著提高球阀微泵的进样效率。
球阀的原位合成原理:在芯片“T型”结构处,水相溶液受到油相液体剪切力作用而产生液滴。一旦有液滴产生后,立刻关闭水相驱动装置(也可先将驱动装置切换至抽取模式,一段时间后再关闭,这样可以避免水相溶液在惯性作用下继续向前流动)。在油相液体驱动下,产生的液滴继续向下游流动,随着流道宽度逐渐减小,碟形的液滴逐渐被拉长,呈长条状塞满窄流道,然后缓慢进入下游单向球阀区的微腔中。由于微腔是芯片中一个相对较大的腔体,所以碟形液滴进入微腔后呈球形。此时,将水相驱动装置调至抽取模式,一方面可以防止油相溶液持续进入微腔将液滴挤入下游通用芯片区,另一方面可以将水相进样流道内的水相溶液排出芯片,防止其受冷后固化堵塞流道。待水相进样流道内的水相溶液全部排出后,移除硅胶导管,将芯片放入冰箱冷藏,使微腔中的液滴固化。过一段时间后取出芯片,即可在芯片中原位合成出微球。
有益效果:相对于微流控芯片现有技术,本发明单向球阀具有以下优势:
(1)本发明单向球阀结构最大的特点就是可利用温控相变材料的“固-液”转换特性在芯片中直接原位合成,不涉及复杂的微加工工艺,大大降低了微泵的加工难度与加工成本,使之在普通实验室中即可加工制作。由凝胶构成的球阀阀芯,可以一直被保留,也可以根据需要移除,如当需要导通流道、不再需要微球进行阀控的时候,只需加热至其熔点即可原位移除,十分方便。凝胶也具有良好的机械强度和可变形性,当反向压力较大时,凝胶球表面会形成塞状突起,紧密封住流道口,所以本发明单向球阀几乎不存在任何漏液情况,这在传统的微阀系统中是难以做到的。
(2)本发明单向球阀结构具有正向导通、反相截止的特性。可以利用该球阀结构成功实现对微控芯片中液体流动方向的控制。同时可以配合外接的储气腔,通过规律压缩与释放气体来实现液体进样。在驱动部件发生损坏时仅需更换储气腔后芯片即可正常使用,便于维修与更换,延长了微控芯片的使用寿命,进一步降低了使用微流控平台的成本。
(3)在微流控芯片系统中加入本发明单向球阀,一方面实现了原位合成与移除球阀阀芯的便捷操作,增加了微流控芯片配件的便携性和可操作性,真正凸显出微流控芯片的优势;另一方面,配合简易的储气腔,即可在极度欠发达地区以及野外环境使用,满足“即时检测”的要求,拓展了微流控芯片的使用范围。
附图说明
图1:本发明用于微控芯片的单向球阀结构示意图;
具体实施方式
实施例1
以PDMS(聚二甲基硅丙烷)为材料,通过“快速光刻-倒模”的方法加工微流控芯片及用于其上的单向球阀。其步骤如下:首先,在抛光硅片上利用快速光刻法制得具有两种不同高度的SU-8胶芯片阳模(阳模高度包括100μm与300μm),然后,通过倒模法分别制得芯片顶板与底板,其中顶板流道与底板流道镜像对称。最后,在显微镜下将芯片顶板与底板对齐,通过两步固化法键合,即可得到完整微流控芯片;
原位合成琼脂糖凝胶微球:按照矿物油:Span 80:Tween 80:Triton X-100=95%:4.5%:0.45%:0.05%的比例配制油相溶液,以3%的琼脂糖溶液作为水相溶液,通过微量注射泵推动微量注射器,驱动两相液体通过第一进样流道6和第二进样流道7进入芯片。液滴产生后,立刻关闭水相注射泵,在油相液体驱动下,产生的液滴继续向下游流动,碟形的琼脂糖液滴逐渐被拉长,呈长条状塞满窄流道8,然后缓慢进入下游单向球阀区的微腔2中,呈球形。此时,将水相注射泵调至抽取模式,待水相进样流道内的琼脂糖溶液全部排出后,将芯片放入冰箱冷藏,使微腔中的琼脂糖液滴固化。过一段时间后取出芯片,此时就已在芯片中原位合成出琼脂糖微球。
所得单向球阀为:包括进样系统1、微腔2、第一分叉流道3、第二分叉流道4以及通用芯片区5,所述进样系统1连接微腔2,微腔2的另一端连接第一分叉流道3和第二分叉流道4,后两者向前延伸重新聚合后与通用芯片区5连接;
微腔2中具有能够高温液态添加,低温固态放置,且能高温液态移除的琼脂糖凝胶微球做为阀芯。
进样系统1包括第一进样流道6、第二进样流道7和窄流道8;所述第一进样流道6和第二进样流道7呈“T”型交汇,交汇点向前延伸与窄流道8相连通,窄流道8与微腔2中部的小孔相通;第一分叉流道3和第二分叉流道4的重新聚合点与通用芯片区5之间还连接有后续流道9;
微腔2的宽度为1125μm,深度为600μm;第一进样流道1和第二进样流道2宽度均为600μm,深度均为200μm;第一分叉流道4和第二分叉流道5的宽度均为200μm,深度均为600μm。
实施例2
按照实施例1方法,将PDMS替换为PMMA(聚甲基丙烯酸甲酯),琼脂糖水溶液替换为丁二胺溶液,油相溶液为植物油,制成带有能够高温液态添加,低温固态放置,且能高温液态移除的丁二胺微球做为阀芯的微流控芯片;
实施例3
按照实施例1方法,将PDMS替换为硅,琼脂糖水溶液替换为石蜡溶液,油相溶液为植物油:矿物油:Span 80=45%:50%:5%,制成带有能够高温液态添加,低温固态放置,且能高温液态移除的石蜡微球做为阀芯的微流控芯片;
实施例4
按照实施例1方法,将PDMS替换为玻璃,琼脂糖水溶液替换为硬脂酸丁酯溶液,油相溶液为植物油:Span 80:吐温80=95%:4%:1%,制成带有能够高温液态添加,低温固态放置,且能高温液态移除的硬脂酸丁酯微球做为阀芯的微流控芯片;
实施例5利用琼脂糖凝胶单向球阀进行可控进样
使用微量注射器代替PDMS空腔,通过使用注射泵反复拉、推注射器来模拟外力压缩与释放PDMS空腔的过程。(使用实施例1所得单向球阀)当注射泵处于抽取状态时,球阀关闭,外部试剂在气压作用下进入微流控芯片后沿着进样流道流入T型结构下方的驱动流道中。当注射泵处于灌注状态时,球阀打开,红色试剂延驱动流道向T型结构两侧流动。最后,试剂被泵入球阀右侧通用芯片区。在该实验中,设定注射泵抽取与灌注时间均为1.5s,总液量为3μL(模拟压缩、释放容积为3μL的PDMS微腔的泵液过程)。当注射泵重复抽取、灌注周期50次后,进入芯片的液体总量为12μL,可见每个驱动周期泵入液量为0.24μL。该过程总耗时150s,所以可计算出平均进样速度为0.08μL/s(288μL/h)。
实施例6
同实施例4,模拟容积为5μL的PDMS微腔的泵液过程。注射泵重复抽取、灌注周期50次后,进入芯片的液体总量为24μL,每个驱动周期泵入液量为0.48μL。
实施例7
同实施例4,模拟容积为10μL的PDMS微腔的泵液过程,注射泵重复抽取、灌注周期50次后,进入芯片的液体总量为50μL,可见每个驱动周期泵入液量为1μL。
实施例8
同实施例4,模拟容积为15μL的PDMS微腔的泵液过程,注射泵重复抽取、灌注周期50次后,进入芯片的液体总量为72μL,可见每个驱动周期泵入液量为1.44μL。
实施例9
同实施例4,模拟容积为20μL的PDMS微腔的泵液过程,注射泵重复抽取、灌注周期50次后,进入芯片的液体总量为97.5μL,可见每个驱动周期泵入液量为1.95μL。
实施例5-9数据汇总如下表:
综合上述五次实验结果可得,每个驱动周期泵入的液量与外部PDMS驱动微腔的容积近似成正比。这与理论分析得到的结果是一致的:在每次泵液都充分压缩PDMS驱动微腔的前提下,每个驱动周期抽入流道内的液体量应与PDMS微腔容积VPDMS相近;在之后的灌注过程中,T型结构两侧流入的液体量与两侧流道的流阻Rr(左侧流道流阻)和Rl(右侧流道流阻)成反比。所以,每次泵液最终流入通用芯片区的液体量为
在同一微流芯片中, 为固定值,所以每次泵液最终进入通用芯片区的液体量与VPDMS成正比。
一种用于微控芯片的单向球阀及其制备方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0