专利摘要
公开一种用于在样品从色谱系统洗脱时在基于所述样品的色谱峰的宽度的时间段内分析所述样品的质谱法的数据独立采集方法。所述方法包含以下步骤:使所述样品离子化以生成多种前体离子,为所述待分析样品选择所关注的前体质量范围,执行多次MS1扫描并且执行至多两组MS2扫描。所述MS1扫描中的每一个使用以第一、相对较高分辨率操作的质量分析器,以用于在所述所关注的前体质量范围中的所述MS1域中识别和/或量化所述样品。所述一组MS2扫描包含执行借助以第二、相对较低分辨率操作的所述质量分析器执行的经碎裂的质量范围区段的MS2扫描。在所述方法中,所述MS1扫描在整个所述一组MS2扫描的执行期间交错进行,使得所述MS1扫描提供所述样品的质量色谱图。还公开一种用于实施以上方法的质谱仪,一种包括用于使所述质谱仪进行所述方法的指令的计算机程序,和一种包含所述计算机程序的计算机可读媒体。
权利要求
1.一种用于分析样品的质谱法的数据独立采集方法,所述方法在所述样品从色谱系统洗脱时在基于所述样品的色谱峰的宽度的时间段内执行,并且包含以下步骤:
将所述样品离子化以生成多种前体离子;
为所述待分析样品选择所关注的前体质量范围;
执行多次MS1扫描,所述MS1扫描中的每一个包含:
使用以在m/z=200amu下的至少50,000的第一、相对较高分辨率操作的质量分析器在所述所关注的前体质量范围上扫描所述样品的前体离子,以用于在所述所关注的前体质量范围上的所述MS1域中识别和/或量化所述样品;以及
通过以下获得一组MS2扫描:
将所述所关注的前体质量范围分成多个前体质量范围区段,其中
对于每个前体质量范围区段:
将在所述质量范围区段内的所述前体离子碎裂,并且
借助以第二、相对较低分辨率操作的所述质量分析器执行所述碎裂的质量范围区段的MS2扫描,使得在所述所关注的前体质量范围上的所述碎裂的样品区段中的每一个碎裂并且在所述MS2域中扫描,
其中在整个所述MS2扫描组中的每一组的所述执行期间交错进行所述MS1扫描的所述执行,使得所述MS1扫描提供所述样品的质量色谱图;并且
获得至多2组MS2扫描。
2.根据权利要求1所述的方法,其中
所述质量分析器是轨道捕集质量分析器。
3.根据权利要求1或权利要求2所述的方法,其中
所述MS2扫描的分辨率小于所述MS1扫描的所述分辨率的一半,并且优选地小于所述MS1扫描的所述分辨率的25%。
4.根据权利要求1、权利要求2或权利要求3所述的方法,其中
所述质量分析器的所述第一、相对较高分辨率为至少60,000,或至少100,000,或至少120,000,或至少140,000。
5.根据任一前述权利要求所述的方法,其中所述质量分析器的所述第二、相对较低分辨率小于30,000,或小于15,000,或小于10,000。
6.根据任一前述权利要求所述的方法,其中
对于每个质量范围区段,所述MS2扫描的分辨率是可变的。
7.根据任一前述权利要求所述的方法,其中
在执行一组MS2扫描花费的时间内执行至少3次、优选地至少5次并且最优选地至少7次MS1扫描。
8.根据任一前述权利要求所述的方法,其中
所述MS1扫描以规则间隔在所述MS2扫描之间交错进行。
9.根据任一前述权利要求所述的方法,其中
在基于所述色谱峰的所述宽度的所述时间段内执行至少7次MS1扫描。
10.根据任一前述权利要求所述的方法,其中
执行的MS1扫描的数目与执行的MS2扫描组的数目的比率为至少3:1。
11.根据任一前述权利要求所述的方法,其中
在基于色谱峰的宽度的所述时间段内执行两组MS2扫描并且执行至少7次MS1扫描。
12.根据任一前述权利要求所述的方法,其中
每个样品区段的每一前体质量范围区段质量的所述质量范围不大于10Da,并且优选地不大于7Da。
13.根据任一前述权利要求所述的方法,其中
基于紧接在前的MS1扫描中所述样品量化/识别的结果动态地修改所述MS2扫描的分辨率。
14.根据任一前述权利要求所述的方法,其中
基于所述紧接在前的MS1扫描中所述样品量化/识别的所述结果动态地修改用于所述MS2扫描中的每一个的所述样品的注射时间。
15.一种用于对样品执行数据独立采集质谱法的质谱仪,所述质谱仪包含:
用于生成多种前体离子的离子化源;
质量分析器;
碎裂设备;
质量选择器;
经配置以从所述质量选择器上游将所述样品的分子分离的色谱系统;以及
控制器,所述控制器经配置以:
(i)使所述质量选择器为所述待分析样品选择所关注的前体质量范围;
(ii)使所述质量分析器以在m/z=200amu下的至少50,000的第一、相对较高分辨率操作,并且在所述所关注的前体质量范围上执行所述样品的所述前体离子的多次MS1扫描,以用于在所述所关注的前体质量范围上的所述MS1域中量化和/或识别所述样品;
(iii)将所述所关注的前体质量范围划分成多个前体质量范围区段;
(iv)控制所述质量选择器以便将所述所关注的前体质量范围分成所述多个质量范围区段;
(v)对于由所述质量选择器生成的每个前体质量范围区段,控制所述碎裂设备以便使在所述质量范围区段内的所述前体离子碎裂;以及
(vi)对于每个前体质量范围区段,使所述质量分析器以第二、相对较低分辨率操作并且执行所述碎裂的样品区段的MS2扫描,使得在所述所关注的前体质量范围上所述碎裂的样品区段中的每一个被碎裂并被扫描以形成一组MS2扫描,
其中所述控制器经配置以在整个所述一组MS2扫描期间使所述多次MS1扫描交错进行,以及
在所述样品从所述色谱系统洗脱时,在基于所述样品的色谱峰的宽度的时间段内执行所述MS1扫描和至多两组MS2扫描,使得所述MS1扫描提供所述样品的质量色谱图。
16.根据权利要求15所述的质谱仪,其中所述质量分析器是轨道捕集质量分析器。
17.根据权利要求15或权利要求16所述的质谱仪,其中
所述控制器经配置以使所述质量分析器以规则间隔执行所述MS1扫描。
18.根据权利要求15到17中任一项所述的质谱仪,其中
所述控制器经配置以使所述质量分析器在基于所述色谱峰的所述宽度的所述时间段内执行至少7次MS1扫描。
19.根据权利要求15到18中任一项所述的质谱仪,其中
所述控制器经配置以使所述质量分析器在基于所述色谱峰的所述宽度的所述时间段内执行两组MS2扫描和至少7次MS1扫描。
20.根据权利要求15到19中任一项所述的质谱仪,其中
所述控制器经配置以将用于所述样品的所述所关注的前体质量范围划分成多个质量范围区段,所述多个质量范围区段各自的质荷比(m/z)范围不大于10Da,并且优选地不大于7Da。
21.根据权利要求15到20中任一项所述的质谱仪,其中
所述控制器经配置以使所述质量分析器以用于所述MS1扫描的第一、相对较高分辨率操作,所述第一、相对较高分辨率为所述MS2扫描的所述第二、相对较低分辨率的至少两倍,并且优选地为所述MS2扫描的所述分辨率的至少4倍。
22.根据权利要求15到21中任一项所述的质谱仪,其中
所述控制器经配置以基于在以所述第一、相对较高分辨率进行的所述紧接在前的MS1扫描中所述样品量化的所述结果,使在进行所述MS2扫描时所述质量分析器的所述分辨率变化。
23.根据权利要求15到22中任一项所述的质谱仪,其中
所述控制器经配置以使在进行所述MS2扫描时用于所述MS2区段中的每一个的进入所述质量分析器的注射时间变化,用于所述MS2区段的所述注射时间是基于在所述紧接在前的MS1扫描中所述样品量化的所述结果。
24.根据权利要求15到23中任一项所述的质谱仪,进一步包含
经配置以基于所述MS1扫描识别存在于所述样品中的前体并且使用所述MS2扫描验证所述识别的处理器。
25.根据权利要求24所述的质谱仪,其中
所述处理器经配置以存取数据依赖型分析算法或无谱库算法,以识别所述样品中的前体并且验证所述识别。
26.一种计算机程序,所述计算机程序包含使根据权利要求15到25中任一项所述的质谱仪执行根据权利要求1到14中任一项所述的方法的所述步骤的指令。
27.一种计算机可读媒体,所述计算机可读媒体具有在其上存储的根据权利要求26所述的计算机程序。
说明书
技术领域
本发明涉及有机样品,特别是生物样品(如蛋白质、肽、代谢物、脂质等)的数据独立分析(DIA)。具体地说,本发明涉及应用于蛋白质组学、代谢组学、脂质组学等中的高分辨率数据独立识别和量化技术。
背景技术
质谱法是用于识别和量化大有机分子的通常复杂混合物的建立已久的技术。近年来,已经开发允许分析广泛范围的生物和非生物材料的技术,所述技术在以下领域中应用:执法(例如毒品和爆炸材料的识别)、环境、科学研究和生物学(例如在蛋白质组学方面,蛋白质的简单和复杂混合物的研究,应用于药物发现、疾病识别等中)。
包含大量氨基酸的蛋白质通常具有相当大的分子量。因此,通过直接质谱测量来精确识别和量化蛋白质是具有挑战性的。因此,进行前体样品材料碎裂是众所周知的。已知可引起由前体离子生成不同片段离子的各种碎裂技术。此外,碎裂机制可受不同的所施加碎裂能量影响。
已知用于从前体生成片段离子的多种不同布置。举例来说,由Thermo FisherScientific LLC出售的装置的TSQ
作为三重四极杆系统的替代,可使用其它装置进行在碎裂之后的质量分析的最后阶段,如飞行时间质谱仪、傅里叶变换离子回旋共振(FT-ICR)质谱仪、轨道捕集质谱仪如 等。每种不同的末级质量分析器在例如质量分辨率、工作周期(误:占空比)、灵敏度、成本等方面具有其自身的优点和缺点。
样品分析可大致上分成数据独立分析/采集(DIA)和数据依赖型分析/采集(DDA)。DIA寻求确定什么存在于潜在未知特性的样品中。为了确定样品分子的分子结构,串连质谱仪中的第一质量过滤器经设定以使在经选择m/z范围内的所有离子通过。然后,使此范围的前体离子在串连质谱仪的第二级中碎裂,并且随后在可为线性四极杆的串连质谱仪的第三级中、TOF装置中或以如上文所提及的其它方式分析所得片段。在宽频带DIA(也称为“全质量/全离子MS/MS”)中,通过使在给定时间下进入质谱仪的所有离子碎裂来采集串连质谱图。替代地,可循序地将各m/z范围的前体离子分离和碎裂,并且然后可检测片段。
相比之下,DDA寻求确认一种或多种物质存在于给定样品中。DDA方法识别固定数量的前体离子物质,并且经由串联质谱法选择和分析那些固定数量的前体离子物质。可基于强度等级(例如通过前体质谱(在下文称为“MS1”))中的峰观测到的前十最大量的物质),或通过限定前体质谱峰的“包含列表”(例如由用户选择),来确定在DDA中哪些前体离子物质是所关注的,片段谱(在下文称为“MS2”)总是通过所述“包含列表”采集而无论前体质谱(MS1)中峰的强度等级如何。而除此以外,可例如由用户基于例如对预期样品内含物的先验知识限定MS1中峰的“排除列表”。
通过简单地将所关注的质量范围(通常由用户限定)划分为区段并且获得每个区段的MS2谱(不同于在上文提及的宽谱带DIA的特定情况),DIA避免在DDA中必要的决策。在DIA的情况下,MS1前体谱的采集变得不同程度地任选,因为前体选择窗口的参数本身携带关于可能的前体离子范围的信息。
DIA技术先前以迈克马斯英国有限公司(Micromass UK Ltd)和WaterTechnologies公司(Water Technologies Corporation)的所谓MS
在US-B-6,717,130中,公开一种技术,其中通过反复地切换碎裂室的能量交替地采集MS1和MS2。所述技术依赖于在色谱环境中通过不同洗脱时间分离样品分子。在实验运行末端,通过比较在两个不同碎裂模式下的质谱识别前体和片段离子。基于片段离子与具体前体离子的洗脱时间的拟合接近度,片段离子与具体前体离子匹配,使得然后可识别前体离子。
US-B-6,982,414公开在上述'130专利中的DIA技术的进展。此处,同样反复地切换施加到碎裂室的能量以便获得MS1和MS2两者。然而,此处单独地从第一样品和第二样品两者获得MS1和MS2。
然后比较并且进行进一步分析质谱,其中不同地表达来自每种样品的MS1中的前体离子或来自每种样品的MS2中的片段离子。
最后,US-B-7,800,055同样采用在碎裂腔室中的能量水平之间切换以便以交替的方式生成MS1和MS2。将前体峰和片段峰的色谱峰形状进行比较以识别前体和片段(产物)离子之间的关联。
在DH Technologies Development私人投资有限公司(DH TechnologiesDevelopment Pte.Ltd)的各种专利中已经提出被称为“SWATH”的DIA的替代方案。
在US-B-809,770中,采集DIA数据集使得所述数据随后可用于目标物质分析。这与设定目标并且然后仅为所述目的而采集数据的想法相当。所述方法采用LC-MS并且将前体离子的宽窗口(例如>10、>15、>20amu)用于MS2,从而允许覆盖全部前体空间。
同样地,'770专利强调通过适当地设定窗口来保持MS2谱中色谱峰的保真度的重要性。MS1谱经指示为任选的。
作为实例,'770专利描述类似于单反应监测(SRM)的方法,所述方法用于评估作为保留时间的函数的前体质量窗口的MS2数据并且用于随后与参考谱库的比较。
US-B-8,809,772采用用于前体离子的可变宽度的分离窗口,所述宽度取决于前体质量。所述方法协调分析速度(对于宽窗口)和灵敏度/特定性(对于窄窗口)。
通过借助MS1信息(如质量精确度、电荷状态、同位素状态、已知的中性丢失等)在提取离子色谱图(XIC)片段峰之间的比较中基于各种标准对XIC峰候选对象进行评分,US-B-9,343,276以公开于US-B-8,809,770中的方法解决缺点。
上述MS
结果是传统的数据库检索(其中如DDA那样,将样品片段谱与库中已知物质的片段谱比较)可不很好地适用于DIA数据分析。在SWATH技术的情况下,必须首先创建大型谱库(对于相同或类似样品类型)以便从复杂谱中靶向提取MS2色谱图,这是昂贵和耗时的任务。
在Yue Xuan等人的“在四极杆-轨道阱质谱仪上的DIA方法的基于MS1的量化优化(MS1Based Quantification Optimization on DIA Methods on a Quadrupole-OrbitrapMass Spectrometer)”(可在
即使那样,对于复杂样品,现有技术DIA方案也需要高MS/MS扫描速度和重复率以及相对较宽的MS/MS窗口,使得存在MS/MS域中的足够数据点以便片段域中的量化和MS1和MS2数据流之间的成功比对。这类高速吞吐量对于高分辨率质量分析器并非最佳。
发明内容
本发明寻求解决现有DIA方案的缺点。根据本发明的第一方面,提供根据权利要求1所述的数据独立分析(DIA)的方法。本发明还涉及根据权利要求15所述的质谱仪。
因此,本发明提出其中在MS1域(即,在前体(未碎裂)离子的情况下)中进行样品的高分辨率识别和/或量化的DIA技术。举例来说,可采用具有100,000或更大分辨率的轨道捕集质量分析器(例如Thermo Fisher Scientific,Inc.的 ),以获得根据其可识别和量化前体离子物质的MS1质谱。由于在MS1域中使用相对较高的分辨率,可区分具有小质量差的两种不同样品分子,例如120,00的MS1扫描分辨率能够区分质量差为c.a.30ppm(百万分之一)的肽。轨道捕集质量分析器还用于以较低分辨率获得MS2谱以提供基于MS1的分析的初步识别的次级确认。
在本公开中,参考质量分析器的分辨率。技术人员将理解本公开中提及的所有分辨率是指在质荷比(m/z)等于200amu(m/z=200amu)下的质量分析器的分辨率。技术人员将理解在其下指定质量分析器的分辨率的m/z比仅指示在所述m/z值下的质量分析器的分辨率,并且不受限于质量分析器根据本发明的方法所扫描的m/z范围。
本发明的方法是用于在样品从色谱系统洗脱时分析样品的质谱法的数据独立采集方法。因此,本发明的DIA方法将在基于在从色谱系统洗脱样品时样品的色谱峰宽度的时间段(即色谱峰的持续时间)内进行。方法包括使样品离子化以生成多种前体离子的步骤和为待分析样品选择所关注的前体质量范围的步骤。方法还包括执行多次MS1扫描,其中MS1扫描中的每次包含:使用以第一、相对较高分辨率操作的质量分析器在所关注的前体质量范围中扫描样品的前体离子,以便在所关注的前体质量范围中的MS1域中识别和/或量化样品。方法还包括执行一组MS2扫描(以及至多两组MS2扫描),其中一组MS2扫描包含:将所关注的前体质量范围分成多个前体质量范围区段,其中对于每个前体质量范围区段,将在所述质量范围区段内的前体离子碎裂,以及借助以第二、相对较低分辨率操作的质量分析器执行碎裂的质量范围区段的MS2扫描,使得在所关注的前体质量范围中的经碎裂样品区段中的每一个碎裂并且在MS2域中被扫描。方法还提供在一组MS2扫描的执行期间交叉进行MS1扫描。
在所关注的质量范围中执行样品的前体离子的多次MS1扫描,使得每次MS1扫描适用于在整个所关注的质量范围中的MS1域中量化和/或识别样品。因此,应理解,MS1扫描中的每一个涉及基本上全部所关注的质量范围。使用以第一、相对较高分辨率操作的质量分析器执行MS1扫描以便在所关注的质量范围中的MS1域中量化样品。因此,质量分析器的相对高的分辨率是这样的分辨率,所述分辨率经选择以便在MS1扫描中减少或最小化并且最优选地消除来自基质或其它样品离子的干扰,从而允许在MS1域中识别和量化前体样品离子。以至少50,000的分辨率执行相对高分辨率的MS1扫描以便充分区分具有类似质量的前体离子,使得可在MS1域中执行精确量化和/或识别。还相对于稍后更详细地描述的所执行MS2扫描的分辨率来限定MS1扫描的相对高分辨率。
MS1扫描经多次执行,与MS2扫描组中的每一个的执行交错进行。因此,在整个一组MS2扫描的执行期间多次重复MS1扫描,以便在色谱峰的持续时间期间反复地对MS1域中的前体离子采样。因此,在样品从色谱系统洗脱时,MS1扫描提供样品的质量色谱图。优选地,在色谱峰的持续时间期间,MS1扫描执行至少3次,更优选地至少5次,并且最优选地至少7次。通过多次重复MS1扫描,可建立前体离子的更精确量化。因此,可重复MS1扫描以便例如以一定采样速率多次对前体离子样品采样。在样品从LC柱(即质谱仪的离子源的上游)洗脱时,优选地在基于样品的LC峰宽度的时间段内执行前述数量的MS1扫描。举例来说,时间段可对应于与如根据LC峰的4倍标准偏差计算的优选地在LC峰底部处的LC峰宽度相等的时间段。可预定MS1扫描的采样速率,或采样速率可响应于例如由于检测到的来自LC柱的洗脱图改变引起的样品递送的改变(例如检测到的标准偏差改变)而变化。下文更详细地描述MS1扫描的可变控制。
对于执行一组MS2扫描中的MS2扫描中的每一个,使用质量选择器如四极杆质量过滤器将所关注的(前体)质量范围分成多个(前体)质量范围区段。可使用除四极杆质量过滤器之外的例如包括质量选择器的其它质量选择器,其中在离子阱或不是质量过滤器的其它装置中执行分离。基于与所关注的前体质量范围相比相对较小的质量范围区段,四极杆质量过滤器过滤(或其它质量选择器选择)前体样品离子。通过将前体样品离子分成相对小的质量范围区段,从一组MS2扫描获得的信息可用于验证来自MS1扫描的量化/识别数据。一组MS2扫描应理解成意指在所关注的整个质量范围中针对相对小质量范围区段中的每个执行单一MS2扫描。
根据本发明方法的,MS1扫描在整个一组MS2扫描的执行期间交错进行。通过以此方式使MS1扫描与MS2扫描交错进行,在整个DIA方法期间由质量分析器对MS1域多次采样,以便提供前体离子的更精确量化,同时在一组MS2扫描中仅对所有质量范围区段采样一次。有利的是,通过使MS1扫描与MS2扫描交错进行,相对于MS2域中一组扫描的采样速率增加MS1域中的采样速率。本发明人已经意识到在仅将MS2域用于验证的DIA方法中,MS2域中一组扫描的采样速率可相对于MS1域中的采样速率而减小。具体地说,本发明人已经开发其中在色谱峰的持续时间期间执行至多两组MS2扫描的DIA方法。本发明人已经意识到通过执行用于样品的量化/识别的高分辨率MS1扫描(>60,000分辨率),在将MS2数据用于验证MS1数据时,不必在色谱峰中执行MS2域的常规采样。因此,本发明人已经开发其中不必在MS2域中获得质量色谱图并且因此可显著减少MS2扫描组的数量的DIA方法。因此,通过在色谱峰中执行至多两组MS2扫描,可供用于执行一组内的每一MS2扫描的时间增加。因此,可优化(改善)MS2域中一组扫描的质量,例如可减少用于一组MS2扫描的质量范围区段的质量范围和/或增加分辨率。替代地,可减少用于执行根据本发明的DIA方法所花费的总时间。在色谱峰中执行两组MS2扫描可改善信噪比,然而,也可以仅以一组MS2扫描执行所述方法。通过仅执行单组MS2扫描,可供用于执行一组MS2扫描的时间量加倍(相对于执行两组MS2扫描)。替代地,通过减少待执行的MS2扫描组的数量,在色谱峰的持续时间期间更多时间可用于执行MS1扫描。因此,可增加执行的MS1扫描的数量,或可增加每次MS1扫描的分辨率。因此,与现有技术方法相比,根据本发明的DIA方法提供在MS1域和MS2域两者的改善。
为待分析样品选择所关注的前体质量范围的步骤可包括以下中的一个或多个:选择用于前体质量范围的下限、选择用于前体质量范围的上限或选择用于前体质量范围的质量窗口宽度。在MS1扫描期间,控制器可控制质量选择器(质量过滤器)以过滤不在所关注的质量范围内的离子。通过过滤不在所关注的质量范围内的离子,可改善MS1扫描的精确度。
所关注的前体质量范围可基于m/z比。用于前体质量范围的下限可由大于0,或更优选地至少10,或至少20,或至少50的m/z比限定。优选地,下限可为至少100,或至少200,或至少300的m/z比,并且最优选地可为至少400的m/z比。用于前体质量范围的上限可由不大于4000的m/z比限定。优选地,用于前体质量范围的上限可由不大于2000,或不大于1600,或更优选地不大于1200的m/z比限定。通过将待在MS1扫描中分析的质量范围限制到所关注的质量范围,可在给定工作周期持续时间内在所关注的质量范围中执行相对高分辨率扫描。替代地,技术人员将了解所关注的质量范围可由质量窗口宽度和质量上限或质量下限中的一个限定。质量窗口宽度可由至少100,或更优选地至少500,或至少750,或至少1000,或至少2000,或至少4000的m/z比范围限定。因此,可通过根据本发明的数据独立采集方法分析不同的所关注质量范围。通过减少选择的所关注的质量范围,可减少完成DIA方法花费的总时间。因此,对操作人员有利的是能够在扫描步骤之前为方法指定/选择所关注的质量范围。
根据选择的所关注的质量范围,在所关注的质量范围中执行样品的前体离子的MS1扫描。使用以第一、相对较高分辨率操作的质量分析器执行MS1扫描以便在所关注的质量范围中的MS1域中量化样品。用于MS1扫描的相对高分辨率为至少50,000并且更优选地至少60,000,或至少75,000,或至少100,000,或至少120,000的分辨率(在轨道捕集质量分析器(如得自Thermo Fisher Scientific的Orbitrap
优选地,用于执行扫描的质量分析器是轨道捕集质量分析器。有利的是,在使用相对紧凑的质量分析器时,通过使用轨道捕集质量分析器,可以相对高分辨率执行MS1扫描并且可以相对低分辨率执行一组MS2扫描。优选地,轨道捕集分析器在至少50,000的分辨率的情况下用于执行MS1扫描,以便提供在MS1域中前体离子的改善的量化。举例来说,根据本发明的轨道质量捕集分析器的相对高分辨率可为至少100,000,并且相对低分辨率(用于MS2扫描)可小于60,000,或小于50,000,或小于40,000,更优选地小于30,000。在一些实施例中,用于MS2扫描的小于20,000,或小于15,000,或小于10,000(例如7,500)的分辨率可为足够的,从而使得能够使用较窄质量范围区段,这有助于验证前体离子的识别/量化。因此,轨道捕集质量分析器可在本发明方法中使用以优化量化前体离子的MS1扫描的分辨率,同时优化验证前体离子的量化的MS2扫描的分辨率。尽管轨道捕集质量分析器可优选地用于提供至少100,000的相对高分辨率,但是技术人员将了解具有至少100,000的分辨率的其它质量分析器也将是合适的。举例来说,可使用多反射飞行时间质谱仪或傅里叶变换离子回旋共振(FT-ICR)质谱仪。轨道捕集质量分析器或FT-ICR质量分析器的高质量精确度能够实现通过MS1扫描的样品识别的高可靠性,其中MS2扫描提供识别的确认。更优选地,质量分析器(例如轨道捕集质量分析器)可用于以至少120,000,或至少130,000,或至少140,000,或至少150,000的相对高分辨率执行MS1扫描。通过增加MS1扫描的分辨率,改善区分各种样品离子和基质离子的能力,从而改善样品量化的精确度。
与用于MS1扫描的分辨率相比,以相对较低的分辨率执行一组或多组MS2扫描。优选地,在MS2域中质量分析器的分辨率小于在MS1域中质量分析器的分辨率的一半。更优选地,在MS2域中质量分析器的分辨率小于40%,或小于30%,或小于25%,或在一些实施例中为约25%,或小于10%的MS 1域中质量分析器的分辨率。因为在MS1域中执行量化,所以可在不影响量化精确度的情况下减少在MS2域中扫描的分辨率。
优选地,MS2扫描的分辨率为至少2,500或至少5,000。可在高于最小分辨率下执行MS2扫描以便确保可足够精确地检测片段离子。优选地,MS2扫描的分辨率不大于75,000。将分辨率增加到高于此限值增加执行MS2扫描需要的时间,这是不期望的。此外,因为仅需要MS2数据用于验证MS1量化,所以不需要在MS2域中执行相对高分辨率扫描。实际上,本发明寻求通过以一定的采样速率在MS1域中对前体离子采样(在相对高分辨率扫描的情况下)来优化DIA方法,所述采样速率高于用于(以相对较低分辨率)执行质量范围区段的一组MS2扫描的采样速率。
通过质量选择器产生的每个质量范围区段经碎裂以便产生用于MS2扫描中的每一个的多种碎裂离子。可使用碎裂室或碎裂腔室执行碎裂。可使用例如以下的使离子碎裂的任何已知方法施行前体离子的碎裂:诱导碰撞离解(CID)、电子转移离解(ETD)、电子捕获离解(ECD)、光诱导离解(PID)或表面诱导离解(SID)。随后,将碎裂离子供应到质量分析器以用于MS2扫描。
优选地,在每个质量范围区段中的质量范围不大于10Da,并且更优选地不大于7Da。通过限制每个区段的质量范围,改善MS2验证步骤的精确度。这是因为减少用于生成用于MS2扫描的片段的前体离子的潜在质量范围。因此,基于用于生成用于MS2扫描中的每一个的碎裂离子的所减少前体质量范围的知识,可执行关于前体离子的更精确验证。举例来说,通过利用每个质量范围区段不大于10Da的质量范围,数据依赖型采集(DDA)谱库可用作MS2验证过程的一部分,从而降低对处理MS2域数据的要求。
优选地,用于每个质量范围区段的质量范围的下限为至少1Da,更优选地2Da,以及最优选地4Da。将每个质量范围区段的质量范围减少到低于所述下限引起在所关注的质量范围上执行过多数量的MS2扫描。因此,在这类质量范围下的MS2扫描的所得分辨率和灵敏度引起在MS2域中不良的验证。
优选地,在一组MS2扫描中的MS2扫描中的每一个的分辨率可为可变的。可基于在作为DIA方法的一部分执行的先前MS1扫描中的数据来动态地修改(“即时”变化)MS2扫描中的每一个的分辨率。先前MS1扫描可为在待执行的MS2扫描之前作为DIA方法的一部分执行的任何MS1扫描。因此,先前MS1扫描可为作为DIA方法的一部分执行的第一(初始)MS1扫描。优选地,先前MS1扫描是根据MS1扫描与MS2扫描的交错进行的紧接在前执行的MS1扫描(最近执行的MS1扫描)。
优选地,基于先前/紧接在前/初始MS1扫描中的样品量化(例如根据MS1域中前体离子峰高度)变化(动态地修改)MS2扫描中的每一个的分辨率。举例来说,在一些样品(例如经胰蛋白酶消化的蛋白质样品)中,低m/z范围具有比高m/z范围高的离子密度。在高密度离子区域中,可使用相对短持续时间、低分辨率扫描来收集足够的离子以用于识别目的。在此情况下,控制器可将MS2扫描的分辨率自动调节到相对低分辨率设定以实现最快的速度。相反地,在低离子密度m/z区域中,控制器可将MS2扫描的分辨率调节到相对较高分辨率。在此情况下,还可由控制器应用用于MS2扫描的相对较长的离子注射时间。以此方式,可改善MS2扫描的信噪比,从而改善低丰度离子的识别率。
一组MS2扫描中的MS2扫描中的每一个的分辨率还可根据所扫描的质量范围区段的质量范围而变化。用于给定质量范围的MS2扫描的分辨率可根据存储在控制器中的预定值来设定,或在分析之前由用户限定的输入或数据文件来设定。
应了解,不需要循序地(例如按质量顺序)执行质量范围区段的MS2扫描,而是它们可经非循序地执行。
优选地,用于执行本发明的DIA方法的时间段与色谱峰的宽度(持续时间)相同。举例来说,可根据峰的标准偏差的倍数(优选地2倍或4倍)计算色谱峰的宽度(持续时间)。替代地,可基于在最大高度的一半处的宽度计算峰宽度。通过精确确定色谱峰的宽度(持续时间),可在峰的持续时间期间对MS1扫描采样,使得改善质量色谱图的精确度,从而改善样品量化的精确度。
优选地,在色谱峰的持续时间期间以规则间隔执行MS1扫描,从而改善样品的质量色谱图的精确度。
优选地,在根据本发明的DIA方法中执行至少7次MS1扫描和两组MS2扫描。因此,当用于执行DIA方法的指定时间段是基于样品的色谱峰的宽度(持续时间)时,在MS1域中对色谱峰采样至少7次。此外,在色谱峰的宽度(持续时间)内执行两组MS2扫描。通过执行两组MS2扫描,可改善MS2验证的精确度,因为在一组MS2扫描的更大比例的质量范围区段可在峰的中心部分中执行而无需(在MS2域中)复现对于样品验证不需要的大量MS2测量值。
因此,与现有技术相比,在本发明的实施例中,独立于用于一组MS2扫描的采样速率设定MS1扫描重复率,使得在色谱峰上采集来自MS1域的足够数量的数据点以允许峰面积的精确确定(量化)。在本发明的实施例中,最大化总体MS2周期长度,但其条件是在典型色谱峰的持续时间内必须为了MS2而对每种前体离子采样至少一次(例如一次或至多两次)。
这产生相对窄(例如≤10Da)的前体分离窗口。在窄前体分离窗口的情况下,在每一个窗口内的不同离子物质的数量减少到其中可进行常规DDA数据分析而无需生成大型、多个前体离子数据库库的程度。
一般来说,本发明是基于意识到用大量MS2扫描组(例如>5)覆盖相同的前体离子未充分利用色谱峰的可用扫描时间。因此,在本发明的DIA方法中,MS1扫描的数量和分辨率经优化以便在色谱峰的持续时间期间以足够的分辨率执行足够数量的MS1扫描,以便在MS1域中量化样品。此外,执行的MS2扫描组的数量经优化以在色谱峰的持续时间期间为验证MS1数据而执行足够数量的MS2扫描组(无需在MS2域中的任何不必要的数据复现)。
用于每一MS2扫描的质量窗口宽度(质量范围区段的质量范围)可相同或其可为可变的。举例来说,对于其中前体峰密度低的所关注质量范围的区域(例如根据MS1扫描(先前/初始/紧接在前的MS1扫描)确定的),与其中峰密度较高的质量范围的区域相比,较宽的窗口宽度可用于MS2质量范围区段。因此,在一些实施例中,用于MS2扫描的质量范围区段的宽度可基于先前MS1扫描而经动态地选择和/或可取决于质量(m/z)。
与本发明的技术相关联的节省的时间可用于较久的离子注射和较高的分辨率,这继而在MS2域中的保真度方面提供益处。
因此,本发明的方面的优点包括更佳的量化精度(由于使用MS1而不是MS2);使用已经建立的DDA库数据库的能力;以及通过最大化离子注射和检测时间而改善的MS2中的MS2数据质量。
可根据包含用于使质谱仪执行根据本发明的方法的步骤的指令的计算机程序操作控制器。因此,在另一方面中,本发明提供包含用于使上述质谱仪执行根据本发明的方法的步骤的指令的计算机程序。在再一方面中,本发明提供具有在其上存储的计算机程序的计算机可读媒体。
应了解,本发明的质谱仪将通常包含其它组件。举例来说,质谱仪将通常包含用于将样品分子离子化并且生成用于质量分析的前体离子的离子化源。所述离子化源可例如为电喷雾离子化源(ESI源)或另一种大气压离子化源。
附图说明
本发明可以用许多方式来实践,并且现将仅借助于实例并且参考附图来描述具体实施例,在所述附图中:
图1示出适于进行根据本发明的实施例的方法的质谱仪的示意性布置。
图2示出叠加到通过液相色谱产生的色谱峰的特性上的根据本发明的实施例的DIA方法的实例。
图3示出表示根据本发明的实施例的MS1扫描和MS2扫描的交错进行的时序图。
图4示出表示根据本发明的实施例的MS2扫描的动态调节的时序图;以及
图5示出根据本发明的实施例的MS1质谱。
具体实施方式
在本文中,术语质量可用于指质荷比,m/z。
图1示出适于进行根据本发明的实施例的方法的质谱仪10的示意性布置。图1的布置示意性地表示来自Thermo Fisher Scientific,Inc.的Q- 质谱仪的构型。
在图1中,将待分析样品(例如来自自动取样器)供应到色谱设备,例如液相色谱(LC)柱(在图1中未示出)。LC柱的一个这类实例为Thermo Fisher Scientific,Inc.的ProSwift整体柱,所述整体柱通过在高压下迫使在流动相中运送的样品通过构成固定相的不规则或球形粒子的固定相来提供高性能液相色谱(HPLC)。在HPLC柱中,样品分子根据其与固定相相互作用的程度而以不同速率洗脱。
可通过使用检测器(例如质谱仪)测量随着时间推移的从HPLC柱洗脱的样品分子的量来产生色谱。从HPLC柱洗脱的样品分子将被检测为在色谱上的基线测量上方的峰。在不同样品分子具有不同洗脱速率的情况下,可检测到在色谱上的多个峰。优选地,个别样品峰及时与在色谱图中的其它峰分离,使得不同样品分子不彼此干扰。
在色谱上,色谱峰的存在对应于时间段,在所述时间段期间样品分子在检测器处存在。因此,色谱峰的宽度等效于样品分子在检测器处存在的时间段。优选地,色谱峰具有高斯形分布,或可假设其具有高斯形分布。因此,可基于根据峰计算的标准差的数确定色谱峰的宽度。举例来说,可基于4色谱峰标准差来计算峰宽。替代地,可基于在峰最大高度的一半处的宽度计算峰宽度。本领域中已知的用于确定峰宽的其它方法也可为合适的。由此,根据本发明的DIA方法采集的MS1数据因此提供从柱中洗脱的样品的质量-色谱图。
然后,使用处于常压的电喷雾电离源(ESI源)20将因此经由液相色谱分离的样品分子电离。然后,样品离子进入质谱仪10的真空腔室并且通过毛细管25导向到仅RF的S透镜30中。离子通过S透镜30集中到将离子注射到具有轴向场的弯曲平杆50中的注射平杆40中。弯曲平杆50引导(带电)离子沿弧形路径通过弯曲平杆50,而不想要的中性分子(例如夹带的溶剂分子)未沿弧形路径引导并且丢失。
离子门(TK透镜)60位于弯曲平杆50的远侧端部并且控制离子从弯曲平杆50到下游四极杆质量过滤器70中的通道。四极杆质量过滤器70典型地但未必为分段式的并且充当带通过滤器,所述过滤器允许经选择的质量数或有限质量范围通过,而排除其它质荷比(m/z)的离子。
然后,离子穿过四极杆出射透镜/对切透镜布置80并且进入转移多极90。转移多极90将经质量过滤的离子从四极杆质量过滤器70引导到弧形阱(C阱)100中。C阱100具有供应有RF电压的纵向延伸的弧形电极和供应有DC电压的端盖。结果为沿着C阱100的弧形纵向轴线延伸的势阱。在第一操作模式中,基于C阱设定DC端盖电压,使得从转移多极90到达的离子在其中将离子冷却的C阱100的势阱中被捕获。离子进入C阱的注射时间(IT)确定一定数量的离子(离子群),所述一定数量的离子随后从C阱射出,进入质量分析器。
经冷却的离子驻留在朝向势阱底部的云部中并且然后从C阱100朝向轨道捕集装置110如由Thermo Fisher Scientific,Inc.出售的 质量分析器垂直地射出。轨道捕集装置110具有偏离中心的注射孔口并且离子通过偏离中心的注射孔口以连贯包注射到轨道捕集装置110中。然后,在轨道捕集装置110内通过超对数电场来捕集离子并且离子经历沿纵向方向的往返运动,同时围绕内部电极运行。
在轨道捕集装置110中的离子包的运动的轴向(z)分量(大体上)定义为简单谐振运动,沿z方向的角频率与给定离子物质的质荷比的平方根有关。因此,随着时间推移,根据其质荷比将离子分离。
通过使用图像检测器(图1中未示出)来检测在轨道捕集装置110中的离子,在离子物质穿过图像检测器时,所述图像检测器产生含有关于所有离子物质的信息的在时域中的“瞬变”。然后,瞬变经受快速傅里叶变换(FFT),从而引起在频域中的一系列峰。根据这些峰,可产生表示丰富/离子强度与m/z的质谱。
在上述构型中,在无需碎裂的情况下,通过轨道捕集装置110分析样品离子(更具体地说,通过四极杆质量过滤器选择的在所关注质量范围内的样品离子的子集)。所得质谱标示为MS1。
还可通过图1的质谱仪10进行MS/MS(或,更一般地说,MS
尽管图1中示出HCD碎裂腔室120,但是可代替地采用其它碎裂装置,所述其它碎裂装置采用如碰撞诱导离解(CID)、电子捕获离解(ECD)、电子转移离解(ETD)、光致离解等的方法。
图1中的碎裂腔室120的“封闭端部”构型(其中前体离子沿第一方向朝向碎裂腔室120从C阱100轴向地射出,并且所得片段离子沿相反的方向返回到C阱100)进一步详细描述于WO-A-2006/103412中。
质谱仪10处于控制器130的控制下,所述控制器130例如经配置以控制捕集组分射出的定时、设定用于聚集和过滤离子的在四极杆等的电极上的适当电势、从轨道捕集装置110获取质谱数据、控制MS1和MS2扫描的序列等。应了解,控制器可包含可根据计算机程序操作的计算机,所述计算机程序包含用于使质谱仪执行根据本发明的方法的步骤的指令。
应理解,图1中示出的组件的具体布置对于随后描述的方法不是必需的。实际上,用于进行本发明的实施例的DIA方法的其它布置是合适的。
现将参考图2和图3描述方法的示例性实施例,其中从作为上述示例性设备(如图1所示)的一部分的液相色谱(LC)柱供应样品离子。
在本发明的示例性实施例中,从LC柱供应样品离子使得根据本发明的实施例的数据独立采集方法在与从LC柱所供应样品的色谱峰对应的持续时间期间采集关于样品离子的数据。因此,控制器经配置以在与色谱峰在其底部处的宽度(持续时间)对应的时间段内执行方法。
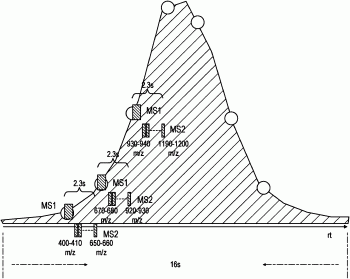
如图2所示,由LC柱产生的色谱峰具有基于16秒持续时间的峰宽度,所述峰宽度根据与图2所示的峰拟合的理想高斯曲线的4倍标准偏差计算。
如图2所示,在DIA方法的过程(工作流)中执行多次MS1扫描和两组MS2扫描。可使用图1中示出的设备(或其它合适的设备)执行MS1扫描。
为了执行单一MS1扫描,使用ESI源20将来自LC柱的样品分子离子化。样品离子随后进入质谱仪10的真空腔室。以如上所述的方式将样品离子导向通过毛细管25、仅RF的透镜30、注射平杆40、弯曲平杆50,并且进入四极杆质量过滤器70中。由控制器130控制四极杆质量过滤器70以根据选择的所关注的前体质量范围过滤样品离子。由质量过滤器70选择宽m/z范围或窗口(例如>500m/z单元),如窗口400-1200m/z。
然后离子穿过四极杆出射透镜/对切透镜布置80,通过转移多极90并且进入C阱100。可将(前体)样品离子从C阱100注射到轨道捕集质量分析器110中。一旦离子在轨道捕集质量分析器内部稳定,就通过使用图像电流检测器检测存在于轨道捕集质量分析器110中的离子来执行MS1扫描。对于MS1扫描,轨道捕集质量分析器中离子的检测经配置以相对高分辨率(相对于MS2扫描的分辨率)执行。
为了执行质量范围区段的单一MS2扫描,以与MS1扫描类似的方式将来自LC柱的样品分子离子化并且注射到质谱仪中。用于MS2扫描的样品离子以与用于MS1扫描的样品离子类似的方式前进通过毛细管25、仅RF的透镜30、注射平杆40、弯曲平杆50并且进入到四极杆质量过滤器70中。
一旦用于MS2扫描的样品离子到达四极杆质量过滤器70,就由控制器控制四极杆质量过滤器70来根据所扫描的质量范围区段的相对窄质量范围(相对于所关注的前体质量范围)过滤样品离子。
如以上针对MS1扫描所描述的,(经过滤的质量区段)前体离子从四极杆质量过滤器70穿过,直到C阱100。然后,控制器引导C阱将前体离子沿轴向方向朝向碎裂腔室120射出。
在HCD碎裂腔室120中,前体离子与高能量碰撞气体分子碰撞,这使前体离子碎裂成片段离子。然后,片段离子从碎裂腔室120向后射出到将片段离子捕集并且冷却的C阱中。然后,将片段离子射出到以相对较低分辨率操作的轨道捕集质量分析器110中以用于分析(MS2扫描)。所得采集的质谱标示为MS2扫描。
根据示例性实施例,控制器130控制质谱仪10以在所关注的质量范围中执行多次MS1扫描,以及另外的一组MS2扫描。
用于每一MS1和MS2扫描的离子化、过滤、捕集、射出、碎裂(用于MS2)和分析的各阶段的定时可由控制器130控制以便优化吞吐量。举例来说,可在轨道捕集质量分析器110中分析前体离子以便获得MS1扫描,而子范围的前体离子在C阱100中被捕集以用于随后在碎裂腔室120中碎裂,或已经在碎裂腔室120中以用于在其中碎裂。替代地,可在C阱100中冷却并捕集片段离子,而在轨道捕集质量分析器110中进行前体离子的分析,使得一旦前体离子分析已经完成,就可将片段离子注射到轨道捕集质量分析器110中以用于获得MS2扫描。
可在色谱峰的持续时间期间重复MS1扫描以便在所述峰的持续时间期间对峰多次采样。优选地,对峰采样至少3次、5次或最佳地7次(如图2所示)。有利的是,通过在MS1域中对峰多次采样,增加在峰上的数据点的数量,从而改善色谱峰中样品前体离子的检测。通过对峰多次采样,可确保在多次MS1扫描中检测样品峰中的前体离子或前体离子中的每一个,从而产生更佳量化精度。
如图2所示,在样品峰的持续时间期间执行7次MS1扫描以便具有用于MS1量化的良好峰形状。因此,以大约16/7≈2.3秒的间隔重复MS1扫描(MS1采样速率为~0.43Hz)。在400到1,200m/z的所关注的质量范围中将用于MS1扫描的分辨率设定为120,000。因此,单一MS1扫描具有大约0.3秒的持续时间,使得用于执行MS1扫描的总持续时间为大约2.1。
相比之下,对于MS2数据,不需要具有富有意义的色谱峰,并且因此在色谱峰的持续时间期间仅执行两组MS2扫描。因此,将用于执行一组MS2扫描需要的持续时间设定为大约6秒。如图2所示,在整个MS2扫描的执行期间交错进行MS1扫描的执行。在图2中示出的实例中,所关注的质量范围经选择为400到1200m/z,并且用于区段中每个的质量范围经选择为10Da。因此,在单组MS2扫描中将需要执行80次MS2扫描。如果用于执行一组MS2扫描的时间均匀地分摊到每一MS2扫描中,那么每一MS2扫描可具有~75毫秒的持续时间。基于用于每一扫描的可用持续时间确定MS2扫描的所得分辨率。举例来说,在图2中,方法使用如上所述的Q HF设备,并且因此可在指定的持续时间中以30,000的分辨率采集每一MS2扫描。因此,如所示出的,可在6.9秒内以需要的MS1采样速率执行与多次MS1扫描交错进行的单组MS2扫描。因此,将两组MS2扫描经优化成在指定色谱峰持续时间内以对于指定质量范围区段可能的最高分辨率执行,同时仍然确保在整个色谱峰期间以规则间隔对MS1域采样。
图3示出用于执行根据参考图2论述的方法的单组MS2扫描的时间序列图。如所论述,在MS2扫描之间每隔2.3秒交错进行MS1扫描,并且用于执行与MS1扫描交错进行的一组MS2扫描的总时间为6.9秒。可看出,在MS1扫描之间对26到27次MS2扫描进行采样。这意指为了采集一组MS2扫描,整个序列为:MS1(400到1200m/z)、MS2(400到410m/z)、MS2(410到420m/z)…MS2(650到660m/z)、MS1(400到1200m/z)、MS2(670到680)…MS2(920到930)、MS1(400到1200m/z)、MS2(930到940)…MS2(1190到1200)。
因此,优选实施例的方法提供具有高分辨率(120,000)的一系列MS1扫描,使得MS1扫描可用于量化前体离子。高质量精确度有助于前体识别的唯一性。碎裂的前体离子的MS2扫描用于验证。由于在MS1域中执行的高分辨率量化,在MS2域中不需要相对大量的时间分辨率,并且因此MS2扫描可经优化以仅用于前体离子识别的验证。此方案允许已改善灵敏度和选择性的质谱法的数据独立采集方法。此外,在MS1域中可使用“无库”方案执行前体离子的量化,从而降低对所采集数据的后处理的要求。
一种用于使用无库方案分析DIA MS1扫描数据和量化前体离子的方法描述于Tsou等人的“DIA-判定:用于数据独立采集蛋白质组学的全面计算框架(DIA-Umpire:comprehensive computational framework for data independent acquisitionproteomics)”(《自然方法(Nat Methods)》,2015年3月第258到264页(March 2015p258-264))中。
优选地,示例性实施例可经进一步修改以使用动态控制(在线调节)来调节MS2扫描。可基于例如在先前MS1扫描中的离子群、预限定的工作周期时间和/或液相色谱柱信息“即时”修改用于每一MS2扫描的分辨率和离子注射时间。
优选地,对于用于执行所述方法的指定时间段(例如基于色谱峰的宽度),可在所述时间段内最大化用于MS2扫描中的每一个的离子注射时间和检测时间。最大化离子注射时间和检测时间直接有利于数据质量,因为信噪比改善。然而,对于一些MS2扫描,例如如上所论述的具有相对高离子密度的质量范围区段,可使用较短持续时间扫描获得可接受的信噪比。因此,可动态地控制MS2扫描,以便通过增加用于一些MS2扫描的扫描持续时间(离子注射时间和/或检测时间)以及减少用于其它MS2扫描的扫描持续时间来改善信噪比。
优选地,对于典型胰蛋白酶蛋白质样品,相对低质量范围区段可具有比相对高质量范围区段更高的离子密度。因此,相对短的离子注射时间(例如10毫秒)可用于相对低质量范围区段,因为归因于在这些m/z区域中相对高的离子密度,可在此时间内收集足够的离子用于识别目的。在此情况下,控制器可自动调节注射时间以减少离子注射时间,以便改善扫描速度。控制器还可将分辨率降低到相对较低分辨率设定(较小过渡时间),以便进一步改善MS2扫描速度。举例来说,响应于测量和/或预期的离子密度,控制器可将注射时间从55毫秒的正常MS2值减少到10毫秒,并且将分辨率从30,000的正常MS2值减少到7,500。在相对低密度离子注射区域中,较长注射时间可被应用和/或处于较高分辨率下。通过增加注射时间和/或分辨率,改善用于低密度离子区域的信噪比。举例来说,控制器可将注射时间从55毫秒的正常值增加到119毫秒,并且分辨率可从30,000的正常值增加到60,000。通过动态地修改MS2扫描参数,可在不增加执行单组MS2扫描需要的总时间的情况下改善MS2扫描的信噪比。应了解,以上作为实例给出的用于MS2设定的正常值可取决于MS2扫描的优化而变化以适合于如在本申请中其他地方所论述的指定质量范围。
下表1中阐述控制器可使用以进行动态地修改的一系列不同分辨率设定和注射时间设定。
表1
表1示出示例性的一系列不同分辨率设定,其中对于每个分辨率设定,示出对应的最大注射时间、检测时间、扫描时间和离子注射时间。同样,对于MS2扫描速度的优化,可基于MS1数据计算离子注射时间,其中所得计算的离子注射时间根据表1中指定的范围确定待应用到MS2扫描的分辨率。因此,对于20毫秒的所计算离子注射时间,将应用15,000的MS2扫描分辨率。
可了解离子注射时间范围和对应的分辨率设定仅为示例性的,并且不同分辨率设定的数值和对应的离子注射时间范围可变化。优选地,对于MS2扫描,存在至少3种不同的分辨率设定,并且更优选地存在至少4种不同分辨率设定。分辨率设定的范围可在至少5,000直至200,000。优选地,分辨率设定可包括以下中的至少一个:5,000、7,500、10,000、12,500、15,000、17,500、20,000、25,000、30,000、35,000、40,000、45,000、50,000、60,000、70,000和80,000。用于分辨率设定中的每一个的离子注射时间范围可在大于1毫秒到不大于150毫秒的范围内。在时间范围中的时间间隔可基于以指定分辨率执行扫描花费的时间。
图4中示出经动态地控制的一组MS2扫描的实例。图4示出基于所计算离子注射时间(IT)和整个一组MS2扫描必须在6秒内完成的条件组合来确定MS2扫描控制,使得仍然在色谱峰的持续时间内完成整个一组MS2扫描以及以120,000分辨率每隔2.3秒进行的MS1扫描。
优选地,方法可进一步经优化以应对由LC柱供应的色谱峰的动态改变。在示例性实施例中,峰宽度为16秒。然而,技术人员将了解在其它实施例中峰宽度可不同。峰宽度还可因色谱条件的变化而动态地变化。因此,为了更精确地确定色谱峰的持续时间,并且因此更精确地确定方法的指定时间段,可动态地确定色谱峰的峰宽度(在线确定)。因此,基于所确定(预测、测量)的色谱峰洗脱图,可动态地调节MS1扫描的采样速率。类似地,可动态地调节MS2扫描的采样速率和/或持续时间(分辨率)。优选地,动态地调节MS1扫描的采样速率,以便确保在色谱峰的持续时间期间执行优选地7次MS1扫描(或另一预先选择数量的MS1扫描,这优选地为至少7次MS1扫描)。优选地,调节扫描速率,使得在色谱峰上以大致规则的间隔执行MS1扫描。因此,如果确定色谱峰的持续时间减少,那么可减少MS1扫描之间的间隔时间。替代地,如果确定色谱峰的持续时间增加,那么可增加MS1扫描之间的间隔时间。应理解,MS1扫描之间的时间间隔用于执行MS2扫描。
有利的是,本发明可用于创建可提供高识别置信度和比本领域中先前已知的方案更佳的量化精度的基于高分辨率MS1的量化DIA工作流。在一些实施例中,本发明能够在MS1水平中和以比在MS2水平中的量化更高程度的灵敏度提供样品中所有可检测特征的100%识别,因为在样品前体碎裂之前(即,在前体未碎裂的情况下)执行量化。
此外,可与从数据依赖型分析(DDA)知晓的常规数据库搜索方案组合地利用本发明的方法以用于DIA数据分析,或可与其它无谱库算法组合地利用本发明的方法以进行DIA数据分析并且提供样品中前体的高置信度识别。以此方式,本发明的DIA方法不需要如同已知的DIA方法中的普遍情况那样预先建立谱库。另外,本发明的方法通过为MS/MS扫描自动匹配离子密度、离子注射时间和分辨率设定来改善MS/MS扫描的肽的识别率。
图5公开由本发明的实施例产生的示例性质谱。在此示例性实施例中,使用120,000的MS1分辨率。由于在MS1域中使用相对高分辨率,可区分质量差为c.a.30ppm(百万分之一)的肽。在此示例性实施例中,两种肽是质量差为18mmu的[Lys-des-Arg
基于高分辨率MS1的量化专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0