专利摘要
一种有机光电转换元件的制造方法,所述有机光电转换元件具有一对电极和设置在一对电极之间的包含高分子化合物的活性层,其中,通过使用包含高分子化合物和被脱氧处理后的溶剂的溶液来形成活性层,从而能够制造光电转换效率优异的有机光电转换元件。
权利要求
1.一种有机光电转换元件的制造方法,所述有机光电转换元件具有一对电极、和设置在一对电极之间的包含高分子化合物的活性层,其中,所述有机光电转换元件的制造方法包括使用包含高分子化合物和被脱氧处理后的溶剂的溶液来形成活性层的工序。
2.根据权利要求1所述的方法,其中,
形成活性层的工序通过在电极上涂布包含高分子化合物和被脱氧处理后的溶剂的溶液来进行。
3.根据权利要求1所述的方法,其中,
脱氧处理是导入氮的处理。
4.根据权利要求1所述的方法,其中,
包含高分子化合物和被脱氧处理后的溶剂的溶液中的氧的重量浓度为25ppm以下。
5.根据权利要求1所述的方法,其中,
包含高分子化合物和被脱氧处理后的溶剂的溶液中的氧的重量浓度为10ppm以下。
6.根据权利要求1所述的方法,其中,
高分子化合物是包含式(1)所示的结构单元的高分子化合物,
式(1)中,Ar1及Ar2相同或不同,且表示3价的芳香族基;Z表示-O-、-S-、-C(=O)-、-CR1R2-、-S(=O)-、-SO2-、-Si(R3)(R4)-、-N(R5)-、-B(R6)-、-P(R7)-或-P(=O)(R8)-;R1、R2、R3、R4、R5、R6、R7及R8相同或不同,且表示氢原子、卤素原子、烷基、烷氧基、烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、酰基、酰氧基、酰胺基、酰亚胺基、亚氨基、氨基、取代氨基、取代甲硅烷基、取代甲硅烷氧基、取代甲硅烷硫基、取代甲硅烷氨基、1价的杂环基、杂环氧基、杂环硫基、芳基烯基、芳基炔基、羧基或氰基;n表示1或2;n为2的情况下,2个Z可以相同也可以不同。
7.根据权利要求6所述的方法,其中,
高分子化合物是还包含以下的式(2-1)~(2-10)中任一个结构单元的高分子化合物,
式(2-1)~(2-10)中,R21~R42各自独立地表示氢原子或取代基;X21~X30各自独立地表示硫原子、氧原子或硒原子。
8.根据权利要求6所述的方法,其中,
高分子化合物是还包含式(2)所示的结构单元的高分子化合物,
式(2)中,X1及X2相同或不同,表示氮原子或=CH-;Y1表示硫原子、氧原子、硒原子、-N(R43)-或-CR44=CR45-;R43、R44及R45相同或不同,表示氢原子或取代基;W1及W2相同或不同,表示氰基、具有氟原子的1价的有机基团、卤素原子或氢原子。
9.包含高分子化合物和溶剂的溶液在有机光电转换元件的制造中的用途,其中,
溶液中的氧的重量浓度为25ppm以下。
10.根据权利要求9所述的用途,其中,
氧的重量浓度为10ppm以下。
11.根据权利要求9所述的用途,其中,
氧的重量浓度为5ppm以下。
12.根据权利要求9所述的用途,其中,
氧的重量浓度为1ppm以下。
13.一种包含高分子化合物和溶剂的溶液,其中,
溶液中的氧的重量浓度为25ppm以下。
14.一种有机光电转换元件,其是通过权利要求1所述的方法获得的。
说明书
技术领域
本发明涉及有机光电转换元件的制造方法。
背景技术
有机光电转换元件具有能够减少元件中的有机层的层数、以及能够利用印刷法制造有机层等优点,与无机光电转换元件相比,能够更简便且廉价地制造。然而,有机光电转换元件的光电转换效率变差成为实用化的阻碍。
作为有机光电转换元件,提出了一种有机光电转换元件,其具有使用包含作为高分子化合物的P3HT和邻二氯苯的溶液而形成的活性层(日本特开2009-158734号公报)。
然而,上述有机光电转换元件的光电转换效率并不充分。
发明内容
本发明提供光电转换效率高的有机光电转换元件的制造方法。
即,本发明提供一种有机光电转换元件的制造方法,所述有机光电转换元件具有一对电极和设置在一对电极间的包含高分子化合物的活性层,其中,所述制造方法包括使用包含高分子化合物和被脱氧处理后的溶剂的溶液来形成活性层的工序。
另外,本发明提供包含高分子化合物和溶剂、且氧的重量浓度为25ppm以下、特别是10ppm以下的溶液在有机光电转换元件材料中的用途。
附图说明
图1为表示本发明涉及的有机光电转换元件的层结构的一例的图。图2及图3为表示本发明涉及的有机光电转换元件的层结构的其他一例的图。
符号说明
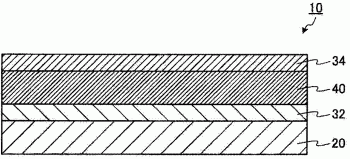
10 表示有机光电转换元件、20 表示基板、32 表示第一电极、34 表示第二电极。40 表示活性层、42 表示第一活性层、44 表示第二活性层、52 表示第一中间层、54 表示第二中间层。
具体实施方式
本发明的有机光电转换元件的制造方法中,用于形成活性层的溶液(以下,将该溶液记为有机光电转换元件材料。)可以通过对包含高分子化合物和溶剂的溶液进行脱氧处理而获得,另外,还可以通过对溶剂进行脱氧处理后再与高分子化合物混合而获得。
脱氧处理可以通过例如在包含高分子化合物和溶剂的溶液中、或在溶剂中导入氮来进行。向溶剂中导入氮可以通过例如使氮气通过管吹入到溶剂中来进行。
在氮浓度调整为1%以下的气氛的手套箱内,在30mL的溶剂中导入氮的情况下,导入氮的时间优选为5分钟以上、更优选为15分钟以上、进一步优选为30分钟以上。在溶剂量大于30mL的情况下,优选延长导入氮的时间。
本发明中,从降低有机光电转换元件材料中的氧的重量浓度的观点出发,在混合高分子化合物和溶剂之前,优选使该高分子化合物在氮气氛下曝露于氮中。作为氮气氛,可列举出调整为氧浓度为1%以下的手套箱,优选在该手套箱中使高分子化合物静置12小时以上。在有机光电转换元件材料包含供电子性化合物或受电子性化合物的情况下,优选使该供电子性化合物或该受电子性化合物在氮气氛下曝露于氮中。
使用有机光电转换元件材料来形成活性层的工序优选为通过在一个电极上涂布有机光电转换元件材料来形成活性层的工序。
作为涂布法,可例示出旋涂法、浇铸法、微凹版涂布法、凹版涂布法、棒涂法、辊涂法、线棒涂法、浸涂法、喷射涂布法、丝网印刷法、凹版印刷、柔性印刷法、胶版印刷法、喷墨印刷法、分配器印刷法、喷嘴涂布法、毛细管涂布法等。其中,优选旋涂法、柔性印刷法、凹版印刷法、喷墨印刷法、分配器印刷法,更优选旋涂法。
本发明涉及的有机光电转换元件材料包含高分子化合物和溶剂,氧的重量浓度通常为25ppm以下。有机光电转换元件材料是用于有机光电转换元件的制造的材料,可以为溶液,也可以为在溶剂中分散了高分子化合物的溶液。
从提高所制造的有机光电转换元件的光电转换效率的观点出发,有机光电转换元件材料中的氧的重量浓度优选为20ppm以下、更优选为10ppm以下。进一步优选为5ppm以下,从进一步提高光电转换效率的观点出发,最优选为1ppm以下。
在有机光电转换元件材料中的氧的重量浓度高的情况下,制造有机光电转换元件后,元件中的氧补足电荷分离后的电子及空穴,引起元件的光电流的下降、曲线因子(FF)的下降,光电转换效率变低。
有机光电转换元件材料中的氧的重量浓度可以通过气相色谱法测定。
活性层中所含的作为供电子性化合物或受电子性化合物的高分子化合物没有特别限定,可以根据这些化合物的能级的能量水平来相对地确定。作为该高分子化合物,可列举出包含以下所示的环式结构的高分子化合物,
以及包含甲基环丁烷、4-乙基环己烷、二甲苯、苯乙烯、乙基苯、噻吩、咪唑、噻唑、吡咯、噁唑等结构的高分子化合物。另外,还可以列举出包含吖丙啶(ethyleneimine)、环氧乙烷、环硫乙烷、氧化乙炔(acetylene oxide)、硫化乙炔(acetylene sulfide)、氮杂环丁烷、1,3-环氧丙烷、硫杂丁环(trimethylene sulfide)、氧鎓离子(oxetium ion)、thietium ion、吡咯烷、四氢呋喃、四氢噻吩、吡咯、呋喃、噻吩、哌啶、四氢吡喃、四氢噻喃、噻喃、环己亚胺、环氧己烷、环硫己烷、氮杂环庚三烯(azatropilidene)、氧代环庚三烯、硫代环庚三烯等结构的高分子化合物。进一步可列举出包含蒽、菲、并四苯、 (chrysene)、芘、苯并[9,10]菲、1,2-苯并蒽(tetraphene)、芘、并五苯、苉、苝、茚、芴、萘、苯并蒽、二苯并菲、苯并噻吩、喹喔啉、吲哚、异吲哚、苯并咪唑、嘌呤、喹啉、异喹啉、噌啉(cinnoline)、蝶啶、色烯、异色烯、吖啶、呫吨、咔唑、卟啉、二氢卟酚、咕啉等结构的高分子化合物。
作为活性层中所含的高分子化合物的例子,可列举出具有式(1)所示的结构单元的高分子化合物。
[式中,Ar1及Ar2相同或不同,且表示3价的芳香族基。Z表示-O-、-S-、-C(=O)-、-CR1R2-、-S(=O)-、-SO2-、-Si(R3)(R4)-、-N(R5)-、-B(R6)-、-P(R7)-或-P(=O)(R8)-。R1、R2、R3、R4、R5、R6、R7及R8相同或不同,且表示氢原子、卤素原子、烷基、烷氧基、烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、酰基、酰氧基、酰胺基、酰亚胺基、亚氨基、氨基、取代氨基、取代甲硅烷基、取代甲硅烷氧基、取代甲硅烷硫基、取代甲硅烷氨基、1价的杂环基、杂环氧基、杂环硫基、芳基烯基、芳基炔基、羧基或氰基。n表示1或2。n为2的情况下,2个Z可以相同也可以不同。]
具有式(1)所示的结构单元的高分子化合物可以是还包含以下的式(2-1)~(2-10)中任一个结构单元的高分子化合物。
〔式中,R21~R42各自独立地表示氢原子或取代基。X21~X30各自独立地表示硫原子、氧原子或硒原子。〕
作为R21~R42所示的取代基,可列举出例如卤素原子、可以具有取代基的烷基、可以具有取代基的烷氧基、可以具有取代基的烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、芳基烯基、芳基炔基、氨基、取代氨基、甲硅烷基、取代甲硅烷基、酰基、酰氧基、酰胺基、杂环基、可以具有取代基的羧基、硝基及氰基。
R21、R22、及R35优选为可以具有取代基的烷基、可以具有取代基的烷氧基及可以具有取代基的烷硫基、更优选为可以具有取代基的烷基及可以具有取代基的烷氧基、进一步优选为可以具有取代基的烷基。从提高本发明的高分子化合物的溶解性的观点出发,R21、R22、R35、R39以及R42优选为分支状的烷基。
R23、R24、R27、R28、R31、R32、R33、R34、R37、R38、R40及R41优选为卤素原子及氢原子,更优选为氟原子及氢原子,进一步优选为氢原子。
R25、R26、R29及R30优选为氢原子、卤素原子、可以具有取代基的烷基、芳基及芳烷基,更优选为氢原子及芳烷基。
R36优选为氢原子、卤素原子、酰基及酰氧基,更优选为酰基及酰氧基。
X21~X30各自独立地表示硫原子、氧原子或硒原子,本发明中从提高光电转换元件的短路电流密度的观点出发,优选硫原子及氧原子,更优选硫原子。
本发明中,从提高光电转换元件的短路电流密度的观点出发,该高分子化合物优选具有式(2-1)、式(2-2)、式(2-3)或式(2-10)所示的结构单元,更优选具有式(2-1)、式(2-2)或式(2-10)所示的结构单元,进一步优选具有式(2-1)或式(2-10)所示的结构单元,特别优选具有式(2-10)所示的结构单元。
另外,具有式(1)所示的结构单元的高分子化合物可以是还包含式(2)所示的结构单元的高分子化合物。
[式中,X1及X2相同或不同,表示氮原子或=CH-。Y1表示硫原子、氧原子、硒原子、-N(R43)-或-CR44=CR45-。R43、R44及R45相同或不同,表示氢原子或取代基。W1及W2相同或不同,表示氰基、具有氟原子的1价的有机基团、卤素原子或氢原子。]
式(2)中,X1及X2表示氮原子或=CH-,但优选X1及X2中至少一个为氮原子,优选X1及X2这两者为氮原子。
式(2)中,作为W1及W2所示的具有氟原子的1价的有机基团,可列举出氟化芳基、氟化烷基、氟化烷硫基、氟化磺酰基、氟化乙酰基等。作为氟化烷基,可列举出氟甲基等。作为氟化芳基,可列举出氟苯基等。这里,作为卤素原子,可列举出氟原子、氯原子、溴原子、及碘原子。
从含有式(2)所示的结构单元的高分子化合物的吸收强度及溶解性的观点出发,W1及W2优选为氟原子。
式(2)中,Y1表示硫原子、氧原子、硒原子、-N(R46)-或-CR47=CR48-,R46、R47及R48相同或不同,表示氢原子、卤素原子或取代基。这里,作为取代基,可列举出烷基、烷氧基、烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、酰基、酰氧基、酰胺基、酰亚胺基、亚氨基、氨基、取代氨基、取代甲硅烷基、取代甲硅烷氧基、取代甲硅烷硫基、取代甲硅烷氨基、1价的杂环基、杂环氧基、杂环硫基、芳基烯基、芳基炔基、羧基、氰基。
从含有式(1)所示的结构单元的高分子化合物的吸收强度及溶解性的观点出发,Y1优选为硫原子、氧原子。
本发明中,卤素原子为氟原子、氯原子、溴原子、及碘原子。
本发明中,烷基可以为直链状也可以为分支状,还可以为环状。烷基的碳数通常为1~30。作为烷基的具体例,可列举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、2-甲基丁基、1-甲基丁基、正己基、异己基、3-甲基戊基、2-甲基戊基、1-甲基戊基、庚基、辛基、异辛基、2-乙基己基、3,7-二甲基辛基、壬基、癸基、十一烷基、十二烷基、十四烷基、十六烷基、十八烷基、二十烷基等链状烷基,环戊基、环己基、金刚烷基等环烷基。
本发明中,烷氧基可以是直链状也可以是分支状,还可以是环状。烷氧基的碳数通常为1~20。作为烷氧基的具体例子,可列举出甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、叔丁氧基、戊氧基、己氧基、环己氧基、庚氧基、辛氧基、2-乙基己氧基、壬氧基、癸氧基、3,7-二甲基辛氧基、月桂氧基,作为被取代的烷氧基的具体例子,可列举出三氟甲氧基、五氟乙氧基、全氟丁氧基、全氟己基、全氟辛基、甲氧基甲基氧基、2-甲氧基乙基氧基等碳数1~20的氟化烷氧基。
本发明中,烷硫基可以为直链状也可以为分支状,还可以为环烷硫基。烷硫基的碳数通常为1~20,作为烷硫基的具体例子,可列举出甲硫基、乙硫基、丙硫基、异丙硫基、丁硫基、异丁硫基、叔丁硫基、戊硫基、己硫基、环己硫基、庚硫基、辛硫基、2-乙基己硫基、壬硫基、癸硫基、3,7-二甲基辛硫基、月桂硫基、三氟甲硫基。
本发明中,芳基的碳数通常为6~60。作为芳基的具体例子,可列举出苯基、C1~C12烷氧基苯基(C1~C12烷基表示碳数1~12的烷基。C1~C12烷基优选为C1~C8烷基、更优选为C1~C6烷基。C1~C8烷基表示碳数1~8的烷基、C1~C6烷基表示碳数1~6的烷基。作为C1~C12烷基、C1~C8烷基及C1~C6烷基的具体例子,可列举出上述烷基中说明并例示的例子。以下皆同。)、C1~C12烷基苯基、1-萘基、2-萘基、五氟苯基。
本发明中,芳氧基的碳数通常为6~60。作为芳氧基的具体例子,可列举出苯氧基、C1~C12烷氧基苯氧基、C1~C12烷基苯氧基、1-萘氧基、2-萘氧基、五氟苯氧基。
本发明中,芳硫基的碳数通常为6~60。作为芳硫基的具体例子,可列举出苯硫基、C1~C12烷氧基苯硫基、C1~C12烷基苯硫基、1-萘硫基、2-萘硫基,作为被取代的芳硫基的具体例子,可列举出五氟苯硫基。
本发明中,芳烷基的碳数通常为7~60。作为芳烷基的具体例子,可列举出苯基-C1~C12烷基、C1~C12烷氧基苯基-C1~C12烷基、C1~C12烷基苯基-C1~C12烷基、1-萘基-C1~C12烷基、2-萘基-C1~C12烷基。
本发明中,芳烷氧基的碳数通常为7~60。作为芳烷氧基的具体例子,可列举出苯基-C1~C12烷氧基、C1~C12烷氧基苯基-C1~C12烷氧基、C1~C12烷基苯基-C1~C12烷氧基、1-萘基-C1~C12烷氧基、2-萘基-C1~C12烷氧基。
本发明中,芳烷硫基的碳数通常为7~60。作为芳烷硫基的具体例子,可列举出苯基-C1~C12烷硫基、C1~C12烷氧基苯基-C1~C12烷硫基、C1~C12烷基苯基-C1~C12烷硫基、1-萘基-C1~C12烷硫基、2-萘基-C1~C12烷硫基。
本发明中,酰基的碳数通常为2~20。作为酰基的具体例子,可列举出乙酰基、丙酰基、丁酰基、异丁酰基、特戊酰基、苯甲酰基、三氟乙酰基、五氟苯甲酰基。
本发明中,酰氧基的碳数通常为2~20。作为酰氧基的具体例子,可列举出乙酰氧基、丙酰氧基、丁酰氧基、异丁酰氧基、特戊酰氧基、苯甲酰氧基、三氟乙酰氧基、五氟苯甲酰氧基。
酰胺基的碳数通常为1~20。酰胺基是指,从酰胺中除去与氮原子结合的氢原子而获得的基团。作为酰胺基的具体例子,可列举出甲酰胺基、乙酰胺基、丙酰胺基、丁酰胺基、苯甲酰胺基、三氟乙酰胺基、五氟苯甲酰胺基、二甲酰胺基、二乙酰胺基、二丙酰胺基、二丁酰胺基、二苯甲酰胺基、二(三氟乙酰胺)基、二(五氟苯甲酰胺)基。
本发明中,酰亚胺基是指,从酰亚胺中除去与氮原子结合的氢原子而获得的基团。作为酰亚胺基的具体例子,可列举出琥珀酰亚胺基、邻苯二甲酰亚胺基。
本发明中,取代氨基的碳数通常为1~40。作为取代氨基的具体例子,可列举出甲基氨基、二甲基氨基、乙基氨基、二乙基氨基、丙基氨基、二丙基氨基、异丙基氨基、二异丙基氨基、丁基氨基、异丁基氨基、叔丁基氨基、戊基氨基、己基氨基、环己基氨基、庚基氨基、辛基氨基、2-乙基己基氨基、壬基氨基、癸基氨基、3,7-二甲基辛基氨基、月桂基氨基、环戊基氨基、二环戊基氨基、环己基氨基、二环己基氨基、吡咯烷基、哌啶基、二(三氟甲基)氨基、苯基氨基、二苯基氨基、C1~C12烷氧基苯基氨基、二(C1~C12烷氧基苯基)氨基、二(C1~C12烷基苯基)氨基、1-萘基氨基、2-萘基氨基、五氟苯基氨基、吡啶基氨基、哒嗪基氨基、嘧啶基氨基、吡嗪基氨基(pyrazylamino group)、三嗪基氨基(triazylamino group)、苯基-C1~C12烷氨基、C1~C12烷氧基苯基-C1~C12烷氨基、C1~C12烷基苯基-C1~C12烷氨基、二(C1~C12烷氧基苯基-C1~C12烷基)氨基、二(C1~C12烷基苯基-C1~C12烷基)氨基、1-萘基-C1~C12烷氨基、2-萘基-C1~C12烷氨基。
本发明中,作为取代甲硅烷基,可列举出例如三甲基甲硅烷基、三乙基甲硅烷基、三-正丙基甲硅烷基、三异丙基甲硅烷基、叔丁基二甲基甲硅烷基、三苯基甲硅烷基、三-对二甲苯基甲硅烷基、三苄基甲硅烷基、二苯基甲基甲硅烷基、叔丁基二苯基甲硅烷基、二甲基苯基甲硅烷基。
本发明中,作为取代甲硅烷氧基,可列举出例如三甲基甲硅烷氧基、三乙基甲硅烷氧基、三-正丙基甲硅烷氧基、三异丙基甲硅烷氧基、叔丁基二甲基甲硅烷氧基、三苯基甲硅烷氧基、三-对二甲苯基甲硅烷氧基、三苄基甲硅烷氧基、二苯基甲基甲硅烷氧基、叔丁基二苯基甲硅烷氧基、二甲基苯基甲硅烷氧基。
本发明中,作为取代甲硅烷硫基,可列举出例如三甲基甲硅烷硫基、三乙基甲硅烷硫基、三-正丙基甲硅烷硫基、三异丙基甲硅烷硫基、叔丁基二甲基甲硅烷硫基、三苯基甲硅烷硫基、三-对二甲苯基甲硅烷硫基、三苄基甲硅烷硫基、二苯基甲基甲硅烷硫基、叔丁基二苯基甲硅烷硫基、二甲基苯基甲硅烷硫基。
本发明中,作为取代甲硅烷氨基,可列举出例如三甲基甲硅烷氨基、三乙基甲硅烷氨基、三-正丙基甲硅烷氨基、三异丙基甲硅烷氨基、叔丁基二甲基甲硅烷氨基、三苯基甲硅烷氨基、三-对二甲苯基甲硅烷氨基、三苄基甲硅烷氨基、二苯基甲基甲硅烷氨基、叔丁基二苯基甲硅烷氨基、二甲基苯基甲硅烷氨基、二(三甲基甲硅烷基)氨基、二(三乙基甲硅烷基)氨基、二(三-正丙基甲硅烷基)氨基、二(三异丙基甲硅烷基)氨基、二(叔丁基二甲基甲硅烷基)氨基、二(三苯基甲硅烷基)氨基、二(三-对二甲苯基甲硅烷基)氨基、二(三苄基甲硅烷基)氨基、二(二苯基甲基甲硅烷基)氨基、二(叔丁基二苯基甲硅烷基)氨基、二(二甲基苯基甲硅烷基)氨基。
本发明中,作为1价的杂环基,可列举出从呋喃、噻吩、吡咯、吡咯啉、吡咯烷、噁唑、异噁唑、噻唑、异噻唑、咪唑、咪唑啉、咪唑烷、吡唑、吡唑啉、吡唑烷、呋咱、三唑、噻二唑、噁二唑、四唑、吡喃、吡啶、哌啶、噻喃、哒嗪、嘧啶、吡嗪、哌嗪、吗啉、三嗪、苯并呋喃、异苯并呋喃、苯并噻吩、吲哚、异吲哚、中氮茚、二氢吲哚、异二氢吲哚、色烯、苯并二氢吡喃、异苯并二氢吡喃、苯并吡喃、喹啉、异喹啉、喹嗪、苯并咪唑、苯并噻唑、吲唑、萘啶、喹喔啉、喹唑啉、喹唑烷(quinazolidine)、噌啉、2,3-二氮杂萘、嘌呤、蝶啶、咔唑、呫吨、菲啶、吖啶、β-咔啉、萘嵌间二氮杂苯、菲咯啉、噻蒽、吩噁噻(phenoxathiin)、吩噁嗪(phenoxazine)、吩噻嗪(phenothiazine)、吩嗪等杂环式化合物中除去1个氢原子后的基团。作为1价的杂环基,优选为1价的芳香族杂环基。
本发明中,作为杂环氧基,可列举出前述1价的杂环基与氧原子结合而成的式(4)所示的基团。作为杂环硫基,可列举出前述1价的杂环基与硫原子结合而成的式(5)所示的基团。
Ar7-O- Ar7-S-
(4) (5)
式(4)及式(5)中,Ar7表示1价的杂环基。
本发明中,杂环氧基的碳数通常为2~60。作为杂环氧基的具体例子,可列举出噻吩基氧基、C1~C12烷基噻吩基氧基、吡咯基氧基、呋喃基氧基、吡啶基氧基、C1~C12烷基吡啶基氧基、咪唑基氧基、吡唑基氧基、三唑基氧基、噁唑基氧基、噻唑氧基、噻二唑氧基。
本发明中,杂环硫基的碳数通常为2~60。作为杂环硫基的具体例子,可列举出噻吩基巯基、C1~C12烷基噻吩基巯基、吡咯基巯基、呋喃基巯基、吡啶基巯基、C1~C12烷基吡啶基巯基、咪唑基巯基、吡唑基巯基、三唑基巯基、噁唑基巯基、噻唑巯基、噻二唑巯基。
本发明中,芳基烯基的碳数通常为8~20,作为芳基烯基的具体例子,可列举出苯乙烯基。
本发明中,芳基炔基的碳数通常为8~20,作为芳基炔基的具体例子,可列举出苯基乙炔基。
作为式(2)所示的结构单元,优选为式(2-1)所示的结构单元、及式(2-2)所示的结构单元。
本发明的高分子化合物除了包含式(1)所示的结构单元以外,还可以进一步包含式(2’)所示的结构单元。
〔式中,Ar3表示亚芳基、或与式(1)所示的结构单元不同的杂亚芳基。〕
本发明中,作为亚芳基,可列举出例如亚苯基、萘二基、蒽二基、芘二基、芴二基。作为杂亚芳基,可列举出例如呋喃二基、吡咯二基、吡啶二基。
式(1)所示的结构单元的优选的形式为式(3)所示的基团。
式(3)中,Ar11及Ar21相同或不同,表示3价的芳香族基。X3表示-O-、-S-、-C(=O)-、-S(=O)-、-SO2-、-Si(R9)(R10)-、-N(R11)-、-B(R12)-、-P(R13)-或-P(=O)(R14)-。
R9、R10、R11、R12、R13及R14相同或不同,表示氢原子、卤素原子、烷基、烷氧基、烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、酰基、酰氧基、酰胺基、酰亚胺基、亚氨基、氨基、取代氨基、取代甲硅烷基、取代甲硅烷氧基、取代甲硅烷硫基、取代甲硅烷氨基、1价的杂环基、杂环氧基、杂环硫基、芳基烯基、芳基炔基、羧基或氰基。R50及R51相同或不同,表示氢原子、卤素原子、烷基、烷氧基、烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、酰基、酰氧基、酰胺基、酰亚胺基、亚氨基、氨基、取代氨基、取代甲硅烷基、取代甲硅烷氧基、取代甲硅烷硫基、取代甲硅烷氨基、1价的杂环基、杂环氧基、杂环硫基、芳基烯基、芳基炔基、羧基或氰基。X3和Ar21与Ar11中所含的杂环的邻接位结合,C(R50)(R51)和Ar11与Ar21中所含的杂环的邻接位结合。
式(3)中,Ar11及Ar21相同或不同,表示3价的芳香族基。3价的芳香族基是指,从芳香族化合物除去芳香环上的3个氢原子后残留的原子团。芳香族化合物可以为碳环化合物也可以为杂环化合物。这里,杂环化合物是指,在具有环式结构的有机化合物中,构成环的元素不仅包含碳原子,在环内还包含氧、硫、氮、磷、硼等杂原子的有机化合物。
作为从芳香族碳环化合物中除去芳香环上的3个氢原子后残留的原子团,例如可列举出以下的式子所示的基团,它们可以被氢原子、卤素原子、烷基、烷氧基、烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、酰基、酰氧基、酰胺基、酰亚胺基、亚氨基、氨基、取代氨基、取代甲硅烷基、取代甲硅烷氧基、取代甲硅烷硫基、取代甲硅烷氨基、1价的杂环基、杂环氧基、杂环硫基、芳基烯基、芳基炔基、羧基或氰基取代。
作为从芳香族杂环化合物中除去芳香环上的3个氢原子后残留的原子团即3价的杂环基,可列举出例如以下的式子所示的基团,它们可以被卤素原子、烷基、烷氧基、烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、酰基、酰氧基、酰胺基、酰亚胺基、亚氨基、氨基、取代氨基、取代甲硅烷基、取代甲硅烷氧基、取代甲硅烷硫基、取代甲硅烷氨基、1价的杂环基、杂环氧基、杂环硫基、芳基烯基、芳基炔基、羧基或氰基取代。
式(201)~式(284)中,R’相同或不同,表示氢原子、卤素原子、烷基、烷氧基、烷硫基、芳基、芳氧基、芳硫基、芳烷基、芳烷氧基、芳烷硫基、取代氨基、酰氧基、酰胺基、芳基烯基、芳基炔基、1价的杂环基或氰基。
R”相同或不同,表示氢原子、烷基、芳基、芳烷基、取代甲硅烷基、酰基或1价的杂环基。
Ar11及Ar21优选均为3价的杂环基,优选至少一方为从噻吩环中除去3个氢原子后的基团,更优选均为从噻吩环中除去3个氢原子后的基团。
另外,式(201)~式(284)中,3价的杂环基优选为包含硫原子的杂环基,更优选为式(268)或式(273)所示的基团,进一步优选为式(273)所示的基团。
R50及R51优选为两者相同或不同,为碳数6以上的烷基、碳数6以上的烷基氧基、碳数6以上的烷硫基、碳数6以上的芳基、碳数6以上的芳氧基、碳数6以上的芳硫基、碳数7以上的芳烷基、碳数7以上的芳烷氧基、碳数7以上的芳烷硫基、碳数6以上的酰基、碳数6以上的酰氧基,进一步优选为碳数6以上的烷基、碳数6以上的烷氧基、碳数6以上的芳基、碳数6以上的芳氧基,特别优选为碳数6以上的烷基。
作为具有式(1)所示的结构单元的高分子化合物,可例示出高分子化合物A。
高分子化合物A具有下述重复单元。式中,n表示重复单元数。
本发明中,活性层中所含的高分子化合物可以为1种也可以为2种以上。另外,高分子化合物起到供电子性化合物的作用或者受电子性化合物的作用是根据这些化合物的能级的能量水平而相对地加以确定的。
本发明的有机光电转换元件材料中所含的高分子化合物从提高有机光电转换效率的观点出发,优选其光吸收端波长为长波长。光吸收端波长优选为700nm以上、更优选为800nm以上、特别优选为900nm以上。
本发明中的光吸收端波长是指通过以下方法求得的值。
测定使用的是在紫外、可见、近红外的波长区域中工作的分光光度计(例如日本分光制、紫外可见近红外分光光度计JASCO-V670)。在使用JASCO-V670的情况下,可测定的波长范围为200~1500nm,因此在该波长范围下进行测定。首先,测定用于测定的基板的吸收光谱。作为基板,使用石英基板、玻璃基板等。接着,在该基板上利用包含高分子化合物的溶液或包含高分子化合物的熔融体来形成包含高分子化合物的薄膜。对于利用溶液的制膜而言,在制膜后进行干燥。然后,获得薄膜和基板的层叠体的吸收光谱。获得薄膜和基板的层叠体的吸收光谱与基板的吸收光谱之差作为薄膜的吸收光谱。
就该薄膜的吸收光谱而言,纵轴表示高分子化合物的吸光度,横轴表示波长。期望按照最大吸收峰的吸光度为0.5~2左右来调整薄膜的膜厚。将吸收峰中最长波长的吸收峰的吸光度设为100%,将包含其50%的吸光度的与横轴(波长轴)平行的直线和该吸收峰的交点即比该吸收峰的峰波长更长的长波长的交点作为第一点。将包含其25%的吸光度的与波长轴平行的直线和该吸收峰的交点即比该吸收峰的峰波长更长的长波长的交点作为第二点。将连接第一点和第二点的直线与基准线的交点定义为光吸收端波长。这里,基准线是指如下所述的直线:在最长波长的吸收峰中,将该吸收峰的吸光度设为100%,将包含其10%的吸光度的与波长轴平行的直线与该吸收峰的交点即比该吸收峰的峰波长更长的长波长的交点的波长作为基准,将比作为基准的波长长出100nm的长波长即吸收光谱上的第三点与比作为基准的波长长出150nm的长波长即吸收光谱上的第4点连接而成的直线。
本发明涉及的有机光电转换元件材料包含溶剂。作为该溶剂,通常使用有机溶剂。作为有机溶剂,可列举出例如甲苯、二甲苯、均三甲苯、四氢化萘、十氢化萘、双环己烷、正丁基苯、仲丁基苯、叔丁基苯等不饱和烃溶剂,四氯化碳、氯仿、二氯甲烷、二氯乙烷、氯丁烷、溴丁烷、氯戊烷、溴戊烷、氯己烷、溴己烷、氯环己烷、溴环己烷等卤代饱和烃溶剂,氯苯、二氯苯、三氯苯等卤代不饱和烃溶剂,四氢呋喃、四氢吡喃等醚溶剂。这些溶剂中,优选卤代不饱和烃溶剂,更优选为二氯苯,进一步优选为邻二氯苯。
有机光电转换元件材料中所含的高分子化合物的量没有特别限定,可以适当选择最适范围,通常,相对于有机光电转换元件材料的重量为0.1重量%以上且10重量%以下、优选为0.3重量%以上且5重量%以下、更优选为0.5重量%以上且3重量%以下。
有机光电转换元件材料除了包含高分子化合物及溶剂以外,还可以包含其他材料。在高分子化合物为供电子性化合物的情况下,作为其他材料,可列举出受电子性化合物。在高分子化合物为受电子性化合物的情况下,作为其他材料,可列举出供电子性化合物。
在有机光电转换元件材料包含作为受电子性化合物和作为供电子性化合物的高分子化合物的情况下,该有机光电转换元件材料中的供电子性化合物的量与受电子性化合物的量的总量相对于有机光电转换元件材料的重量,通常为0.2重量%以上且20重量%以下,优选为0.5重量%以上且10重量%以下,更优选为1重量%以上且5重量%以下。另外,供电子性化合物与受电子性化合物的配合比通常为1~20∶20~1,优选为1~10∶10~1,进一步优选为1~5∶5~1。在分别制备供电子性化合物的溶液与受电子性化合物的溶液的情况下,供电子性化合物或受电子性化合物通常添加0.4重量%以上,优选添加0.6重量%以上,更优选添加2重量%以上。
作为供电子性化合物,可列举出例如吡唑啉衍生物、芳基胺衍生物、芪衍生物、三苯基二胺衍生物、低聚噻吩及其衍生物、聚乙烯基咔唑及其衍生物、聚硅烷及其衍生物、侧链或主链具有芳香族胺残基的聚硅氧烷衍生物、聚苯胺及其衍生物、聚噻吩及其衍生物、聚吡咯及其衍生物、聚苯乙炔及其衍生物、聚噻吩乙炔及其衍生物。
作为受电子性化合物,可列举出例如噁二唑衍生物、蒽醌二甲烷及其衍生物、苯醌及其衍生物、萘醌及其衍生物、蒽醌及其衍生物、四氰基蒽醌二甲烷及其衍生物、芴酮衍生物、二苯基二氰基乙烯及其衍生物、联苯醌衍生物、8-羟基喹啉及其衍生物的金属络合物、聚喹啉及其衍生物、聚喹喔啉及其衍生物、聚芴及其衍生物、C60等的富勒烯类及其衍生物、浴铜灵(bathocuproine)等菲咯啉衍生物、氧化钛等金属氧化物、纳米碳管等。作为受电子性化合物,优选为氧化钛、纳米碳管、富勒烯、富勒烯衍生物,特别优选可举出富勒烯、富勒烯衍生物。富勒烯衍生物表示富勒烯的至少一部分被修饰后的化合物。
作为富勒烯的例子,可列举出C60富勒烯、C70富勒烯、C76富勒烯、C78富勒烯、C84富勒烯等。
作为富勒烯衍生物,可列举出例如式(6)所示的化合物、式(7)所示的化合物、式(8)所示的化合物、式(9)所示的化合物。
式(6)~(9)中,Ra为烷基、芳基、杂芳基或具有酯结构的基团。多个Ra可以相同也可以不同。Rb表示烷基或芳基。多个的Rb可以相同也可以不同。
就Ra所示的具有酯结构的基团而言,可列举出例如式(10)所示的基团。
(式中,u1表示1~6的整数、u2表示0~6的整数,Rc表示烷基、芳基或杂芳基。)
本发明中,作为杂芳基的具体例子,可列举出噻吩基、吡咯基、呋喃基、吡啶基、喹啉基、异喹啉基。
作为富勒烯、富勒烯衍生物的例子,可列举出C60、C70、C76、C78、C84及其衍生物。作为C60富勒烯的衍生物、C70富勒烯的衍生物,可列举出以下的化合物。
另外,作为富勒烯衍生物的例子,可列举出[5,6]-苯基C61丁酸甲酯([5,6]-PCBM)、[6,6]苯基-C61丁酸甲酯(C60PCBM、[6,6]-Phenyl C61butyric acid methyl ester)、[6,6]苯基-C71丁酸甲酯(C70PCBM、[6,6]-Phenyl C71 butyric acid methyl ester)、[6,6]苯基-C85丁酸甲酯(C84PCBM、[6,6]-Phenyl C85 butyric acid methyl ester)、[6,6]噻吩基-C61丁酸甲酯([6,6]-Thienyl C61 butyric acid methyl ester)等。
对于本发明涉及的有机光电转换元件,使用附图进行说明。
以下说明中所示的附图中的各部件的缩小比例存在与实际不同的情况。另外,有机光电转换元件也存在电极的导线等部件,但由于与本发明的说明没有直接关系,因而省略了记载及图示。另外,在以下的说明中,有时将基板的厚度方向的一方称为“上方”或“上”,将基板的厚度方向的另一方称为“下方”或“下”。该上下关系是为了方便说明而设定的,因而未必适用于实际制造有机光电转换元件的工序以及所使用的状况。
本发明涉及的有机光电转换元件的基本结构是具有一对电极和活性层的结构。一对电极中的至少一个通常为透明或半透明的。有机光电转换元件中,阳极通常为透明或半透明的电极。有机光电转换元件可以具有不透明的电极。在有机光电转换元件具有不透明的电极的情况下,不透明的电极通常为阴极。有机光电转换元件中的活性层的位置在一对电极间。活性层可以为1层、也可以为多层。另外,在一对电极间可以设置除了活性层以外的层,在本说明书中有时将该层称为中间层。
活性层包含1种以上的有机化合物。至少1种的有机化合物为高分子化合物。作为有机化合物,可例示出供电子性化合物(p型半导体)和受电子性化合物(n型半导体)。活性层可以为单层,也可以为多层重叠而成的层叠体。作为活性层的形态,可例示出:利用供电子性化合物形成的层(供电子性层)与利用受电子性化合物形成的层(受电子性层)重叠而成的、所谓的pn异质结型的形态,供电子性化合物和受电子性化合物混合而形成了本体异质结结构的本体异质结型的形态。本发明中的活性层可以为任意形态。
对于有机光电转换元件的层结构的例子,边参照图1~图3边进行说明。图1~图3是分别表示有机光电转换元件的层结构的例子的图。以下,对于图1进行说明后,对于图2,仅说明其与图1的不同点,对于图3,仅说明其与图1及图2的不同点。
图1的例子中,在基板20上搭载在第一电极32及第二电极34间夹持有活性层40的层叠体,构成有机光电转换元件10。在从基板20侧采光的情况下,基板20为透明或半透明。
第一电极32及第二电极34中的至少一个为透明或半透明。在从基板20侧采光的情况下,第一电极32为透明或半透明。
第一电极32及第二电极34中的任一个为阳极且任一个为阴极,没有特别限定。例如,在从基板20侧依次层叠来制造有机光电转换元件10的情况下,阴极(例如铝等)的成膜若使用蒸镀法,则存在优选蒸镀是更靠后的工序的情况。因此,在该例子的情况下,第一电极32优选为阳极、第二电极34优选为阴极。另外,在该例子的情况下,存在铝电极因为厚度的设定的不同而难以制成透明或半透明的情况。因此,为了能够从基板20侧采光,优选基板20及第一电极32形成为透明或半透明的。
图2的例子中,活性层40由第一活性层42及第二活性层44这2层而构成,为pn异质结型的活性层。第一活性层42及第二活性层44中的一层为受电子性层、另一层为供电子性层。
图3的例子中,设置有第一中间层52和第二中间层54。分别是第一中间层52位于活性层40与第一电极32之间,第二中间层54位于活性层40与第二电极34之间。第一中间层52与第二中间层54可以仅设置任一层。另外,图3中描绘了作为单层的各中间层,但各中间层可以由多层构成。
中间层可以具有各种功能。若假定第一电极32为阳极,则第一中间层52可以为例如空穴输送层、电子阻挡层、空穴注入层以及具有其他功能的层。在该情况下,第二电极34为阴极,第二中间层54例如可以为电子输送层、电子阻挡层以及具有其他功能的层。相反地,在将第一电极32作为阴极、第二电极34作为阳极的情况下,与其相应地中间层也分别替换位置。
活性层中所含的供电子性化合物、受电子性化合物没有特别限定,可以根据这些化合物的能级的能量水平而相对地确定。
供电子性化合物可以单独用于活性层,也可以组合2种以上来用于活性层。受电子性化合物可以将1种化合物用于活性层、也可以组合2种以上的化合物来用于活性层。
本发明的有机光电转换元件材料优选被用于活性层的形成。
在活性层包含前述高分子化合物和作为受电子性化合物的富勒烯衍生物的情况下,活性层中的富勒烯衍生物的量相对于前述高分子化合物100重量份,优选为10~1000重量份,更优选为20~500重量份。
在制造活性层为本体异质结型的有机光电转换元件的情况下,例如,将包含前述高分子化合物与供电子性化合物或受电子性化合物的溶液供给到基于不同频率的2次以上的超声波处理,然后将处理后的溶液涂布到电极上,使溶剂挥发,由此能够形成活性层。
另一方面,在制造活性层为pn异质结型的有机光电转换元件的情况下,例如,将本发明的有机光电转换元件材料和包含受电子性化合物的溶液供给到基于不同频率的2次以上的超声波处理,然后将处理后的有机光电转换元件材料涂布到电极上,使溶剂挥发,形成供电子性层。接着,将相同处理后的包含受电子性化合物的溶液涂布到供电子性层上,使溶剂挥发,形成受电子性层。由此能够形成2层结构的活性层。供电子性层及受电子性层的形成顺序可以与上述相反。
活性层的厚度通常为1nm~100μm、优选为2nm~1000nm、更优选为5nm~500nm、进一步更优选为20nm~200nm。
基板只要是在形成电极、形成有机物的层时没有化学变化的基板即可。作为基板的材料,可列举出例如玻璃、塑料、高分子膜、硅等。在不透明的基板的情况下,相反的电极(即,一对电极中的远离基板的一方的电极)优选为透明或半透明。
作为构成透明或半透明的电极的电极材料,可例示出导电性的金属氧化物膜、半透明的金属薄膜等。具体来说,可以使用利用氧化铟、氧化锌、氧化锡、及作为它们的复合体的铟·锡·氧化物(ITO)、铟·锌·氧化物(IZO)、NESA等导电性材料所制作的膜,金、铂、银、铜等的金属薄膜;优选为使用包含ITO、铟·锌·氧化物、氧化锡等导电性材料所制作的膜。作为电极的制作方法,可例示出真空蒸镀法、溅射法、离子镀法、镀敷法等。另外,作为电极材料,可以使用聚苯胺及其衍生物、聚噻吩及其衍生物等的有机透明导电膜。
与透明或半透明的电极成对的电极可以为透明或半透明,也可以不是透明或半透明的。作为构成该电极的电极材料,可以使用金属、导电性高分子等。作为该电极材料的具体例子,可列举出锂、钠、钾、铷、铯、镁、钙、锶、钡、铝、钪、钒、锌、钇、铟、铈、钐、铕、铽、镱等金属;前述金属中的2种以上的合金;1种以上的前述金属与选自金、银、铂、铜、锰、钛、钴、镍、钨及锡中的1种以上的金属的合金;石墨、石墨层间化合物;聚苯胺及其衍生物、聚噻吩及其衍生物。作为合金,可列举出镁-银合金、镁-铟合金、镁-铝合金、铟-银合金、锂-铝合金、锂-镁合金、锂-铟合金、钙-铝合金等。
作为中间层的材料,可例示出氟化锂(LiF)等碱金属或碱土金属的卤化物或氧化物、氧化钛等无机半导体的微粒、金属醇盐(metal alkoxides)、PEDOT(聚(3,4)乙烯二氧噻吩)。这些材料中,阳极侧的中间层优选为包含PEDOT的层。阴极侧的中间层优选包含碱金属的卤化物的层、由异丙醇钛形成的二氧化钛的薄膜层,更优选包含氟化锂(LiF)的层、由异丙醇钛形成的二氧化钛的薄膜层。
本发明制造的有机光电转换元件可以通过从透明或半透明的电极照射太阳光等光,由此在电极间产生光电动势(photovoltaic power),作为有机薄膜太阳能电池进行工作。
通过集成多个有机薄膜太阳能电池,还可以用作有机薄膜太阳能电池模块。
另外,在对电极间施加电压的状态、或者未施加电压的状态下,通过从透明或半透明的电极照射光,从而光电流流动,作为有机光传感器进行工作。通过集成多个有机光传感器,还能够用作有机图像传感器。
有机薄膜太阳能电池可以采用与以往的太阳能电池模块基本相同的模块结构。太阳能电池模块通常采用如下结构:在金属、陶瓷等的支撑基板上构成单元,将其上用填充树脂或保护玻璃等覆盖,从支撑基板的相反侧取入光,也可以制成如下结构:支撑基板使用强化玻璃等透明材料,在其上构成单元,从该透明的支撑基板侧取入光。具体来说,已知:被称为超直型、副直型、灌封型的模块结构,无定形硅太阳能电池等中使用的基板一体型模块结构等。本发明的有机薄膜太阳能电池还可以根据使用目的、使用地点以及环境来适当选择这些模块结构。
作为代表的超直型或者副直型的模块形成如下结构:在单侧或两侧为透明且被实施了防反射处理的支撑基板之间按照一定间隔来配置单元,相邻的单元之间通过金属导线或挠性配线等连接,在外缘部配置有集电电极,将所产生的电力取出到外部。在基板与单元之间,为了保护单元和提高集电效率,可以根据目的而以膜或填充树脂的形式使用乙烯醋酸乙烯酯(EVA)等各种各样的塑料材料。另外,在受到来自外部的冲击少的地方等不需要将表面用较硬的原材料覆盖的地点使用的情况下,可以以透明塑料膜的形式构成表面保护层,或通过使上述填充树脂固化而赋予保护功能,并且可以省略单侧的支撑基板。就支撑基板的周围而言,为了确保内部的密封及模块的刚性,而用金属制的框固定成夹层状,在支撑基板与框之间用密封材料进行密封。另外,单元本身、支撑基板、填充材料以及密封材料若使用挠性原材料,则还可以在曲面上构成太阳能电池。
在使用了聚合物膜等挠性支撑体的太阳能电池的情况下,一边将辊状的支撑体送出,一边依次形成单元,剪切成所需的尺寸后,通过将周缘部用挠性且具有防湿性的原材料密封,从而能够制作电池本体。另外,还可以制成Solar Energy Material sand Solar Cells,48,p383-391中记载的被称为“SCAF”的模块结构。进一步,使用挠性支撑体的太阳能电池还可以粘接固定在曲面玻璃等上而使用。
若成膜时在溶液中存在不溶成分、粉尘,则在涂布膜上会产生裂纹、或者以不需要的成分、粉尘为核而产生凝聚粒。由此,在接合界面的电接触、化学接触变得不良,或者产生漏电流。通过减少这种情况,从而提高光电转换效率。
实施例
合成例1
(化合物1的合成)
向将烧瓶内的气体用氩置换后的1000mL的四口烧瓶中加入3-溴噻吩13.0g(80.0mmol)、二乙基醚80mL,形成均匀的溶液。在将溶液保持在-78℃的状态下,滴加2.6M的正丁基锂(n-BuLi)的己烷溶液31mL(80.6mmol)。在-78℃下使其反应2小时后,滴加在二乙基醚20mL中溶解了3-噻吩甲醛8.96g(80.0mmol)而得的溶液。滴加后,在-78℃下搅拌30分钟,进一步在室温(25℃)下搅拌30分钟。将反应液再次冷却到-78℃,用15分钟滴加2.6M的n-BuLi的己烷溶液62mL(161mmol)。滴加后,将反应液在-25℃下搅拌2小时,进一步在室温(25℃)下搅拌1小时。然后,将反应液冷却到-25℃,用30分钟滴加在二乙基醚1000mL中溶解了碘60g(236mmol)而得的溶液。滴加后,在室温(25℃)下搅拌2小时,加入1N的硫代硫酸钠水溶液50mL后停止反应。用二乙基醚提取反应产物后,用硫酸镁干燥、浓缩,获得35g的粗产物。通过使用氯仿对粗产物进行重结晶而进行精制,从而获得28g化合物1。
(化合物2的合成)
向300mL的四口烧瓶中加入双碘代噻吩基甲醇(bisiodothienyl methanol)(化合物1)10.5g(23.4mmol)、二氯甲烷150mL,形成均匀的溶液。向该溶液中加入氯铬酸吡啶鎓(pyridinium chlorochromate)7.50g(34.8mmol),在室温(25℃)下搅拌10小时。过滤反应液,除去不溶物后,将滤液浓缩,获得10.0g(22.4mmol)化合物2。
(化合物3的合成)
向将烧瓶内的气体用氩置换后的300mL烧瓶中加入化合物210.0g(22.4mmol)、铜粉末6.0g(94.5mmol)、脱水N,N-二甲基甲酰胺(以下,有时称为DMF)120mL,在120℃下搅拌4小时。反应后,将烧瓶冷却至室温(25℃),将反应液通入硅胶柱,除去不溶成分。然后,加入水500mL,用氯仿提取反应产物。用硫酸镁干燥作为氯仿溶液的油层,进行浓缩,获得粗制物。将该粗制物用展开溶剂为氯仿的硅胶柱进行精制,获得3.26g化合物3。进行多次到此为止的操作。
(化合物4的合成)
向将烧瓶内的气体用氩置换后的烧瓶中加入10.0g(5.20mmol)化合物3、四氢呋喃(以下,有时称为THF。)100mL,形成均匀的溶液。将烧瓶保持在0℃,用15分钟加入N-溴代琥珀酰亚胺(以下,有时称为NBS。)2.31g(1.30mmol)。然后,在0℃下搅拌2小时,过滤所析出的固体而获得,用10wt%硫代硫酸钠水溶液及水进行洗涤。将所得的固体称为粗制物4-A。然后,向滤液中加入10wt%的硫代硫酸钠水溶液200mL,用氯仿进行提取。用硫酸钠干燥作为氯仿溶液的有机层,进行浓缩,获得所析出的固体。将所得的固体称为粗制物4-B。合并粗制物4-A与粗制物4-B,通过展开溶剂为氯仿的硅胶柱色谱法进行精制,获得17.3g化合物4。进行多次到此为止的操作。
(化合物5的合成)
向具有机械搅拌器且将烧瓶内的气体用氩置换后的1000mL的四口烧瓶中加入25.0g(71.4mmol)化合物4、氯仿250mL、三氟醋酸160mL,形成均匀的溶液。用35分钟向该溶液中加入过硼酸钠一水合物21.0g(210mmol),在室温(25℃)下搅拌240分钟。然后,向反应液中加入5wt%的亚硫酸钠水溶液500mL,停止反应,加入碳酸氢钠直至反应液的pH为6。然后,用氯仿提取反应产物,将作为氯仿溶液的有机层通入硅胶柱,用蒸发器处理溶出液,馏去溶剂。用甲醇对残渣进行重结晶,获得7.70g(21.0mmol)化合物5。进行多次到此为止的操作。
(化合物6的合成)
向将烧瓶内的气体用氩置换后的2000mL烧瓶中加入23.1g(63.1mmol)化合物5、THF 1500mL,形成均匀的溶液。将烧瓶冷却到-50℃,用10分钟滴加1mol/L的正辛基溴化镁的THF溶液190mL。将反应液在-50℃下搅拌30分钟后,加入水500mL,停止反应。将反应液升温至室温(25℃),用蒸发器馏去THF1000mL,加入醋酸100mL。用氯仿提取反应产物,然后,用硫酸钠干燥氯仿溶液,用蒸发器馏去溶剂。将所得固体用己烷进行洗涤,在减压下干燥,获得10.9g化合物6。
(化合物7的合成)
向将烧瓶内的气体用氩置换后的100mL的四口烧瓶中加入1.00g(4.80mmol)化合物6和脱水THF 30ml,形成均匀的溶液。一边将烧瓶保持在-20℃,一边加入1M的3,7-二甲基辛基溴化镁的醚溶液12.7mL。然后,用30分钟将反应液的温度提高到-5℃,在该状态下搅拌30分钟。然后,用10分钟将反应液的温度提高到0℃,在该状态下搅拌1.5小时。然后,向反应液中加入水,停止反应,用醋酸乙酯提取反应产物。用硫酸钠干燥作为醋酸乙酯溶液的有机层,通入硅胶柱,从溶出液中馏去溶剂,获得1.50g化合物7。
1H NMR in CDCl3(ppm):8.42(b、1H)、7.25(d、1H)、7.20(d、1H)、6.99(d、1H)、6.76(d、1H)、2.73(b、1H)、1.90(m、4H)、1.58-1.02(b、20H)、0.92(s、6H)、0.88(s、12H)
(化合物8的合成)
向将烧瓶内的气体用氩置换后的200mL烧瓶中加入1.50g化合物7、甲苯30mL,形成均匀的溶液。向该溶液中加入对甲苯磺酸钠一水合物100mg,在100℃下搅拌1.5小时。将反应液冷却至室温(25℃)后,加入水50mL,用甲苯提取反应产物。用硫酸钠干燥作为甲苯溶液的有机层,馏去溶剂。将所得粗产物通过展开溶剂为己烷的硅胶柱进行精制,获得1.33g化合物8。进行多次到此为止的操作。
1H NMR in CDCl3(ppm):6.98(d、1H)、6.93(d、1H)、6.68(d、1H)、6.59(d、1H)、1.89(m、4H)、1.58-1.00(b、20H)、0.87(s、6H)、0.86(s、12H)
(化合物9的合成)
向将烧瓶内的气体用氩置换后的200mL烧瓶中加入2.16g(4.55mmol)化合物8、脱水THF 100mL,形成均匀的溶液。将该溶液保持在-78℃,用10分钟向该溶液中滴加2.6M的正丁基锂的己烷溶液4.37mL(11.4mmol)。滴加后,将反应液在-78℃下搅拌30分钟,接着,在室温(25℃)下搅拌2小时。然后,将烧瓶冷却到-78℃,加入三丁基氯化锡4.07g(12.5mmol)。添加后,在-78℃下搅拌30分钟,接着,在室温(25℃)下搅拌3小时。然后,加入水200ml,停止反应,用醋酸乙酯提取反应产物。用硫酸钠干燥作为醋酸乙酯溶液的有机层,用蒸发器馏去溶剂。将所得的油状的物质通过展开溶剂为己烷的硅胶柱进行精制,获得3.52g(3.34mmol)化合物9。硅胶柱的硅胶使用的是事先在包含5wt%的三乙胺的己烷中浸渍5分钟,然后用己烷洗涤而得的硅胶。
合成例2
(化合物10的合成)
向500ml烧瓶中加入4,5-二氟-1,2-二氨基苯(东京化成工业制)10.2g(70.8mmol)、吡啶150mL,形成均匀的溶液。在将烧瓶保持在0℃的状态下,向烧瓶内滴加亚硫酰二氯16.0g(134mmol)。滴加后,将烧瓶加热到25℃,进行6小时反应。然后,加入水250ml,用氯仿提取反应产物。用硫酸钠干燥作为氯仿溶液的有机层,用蒸发器进行浓缩。用甲醇对所析出的固体进行重结晶,获得10.5g(61.0mmol)精制后的化合物10。
1H NMR(CDCl3、ppm);7.75(t、2H)
19F NMR(CDCl3、ppm):-128.3(s、2F)
(化合物11的合成)
向100mL烧瓶中加入2.00g(11.6mmol)化合物10、铁粉0.20g(3.58mmol),将烧瓶加热到90℃。用1小时向该烧瓶中滴加溴31g(194mmol)。滴加后,在90℃下搅拌38小时。然后,将烧瓶冷却至室温(25℃),加入氯仿100mL,进行稀释。将所得溶液注入到5wt%的亚硫酸钠水溶液300mL中,搅拌1小时。将所得混合液的有机层用分液漏斗进行分离,将水层用氯仿提取3次。将所得提取液与先前分离的有机层合并,用硫酸钠干燥,用蒸发器馏去溶剂。将所得黄色的固体溶解于加热到55℃的甲醇90mL中,然后,冷却至25℃。过滤所析出的结晶,在室温(25℃)下减压干燥,获得1.50g化合物11。
19F NMR(CDCl3、ppm):-118.9(s、2F)
合成例3
(高分子化合物A的合成)
向将烧瓶内的气体用氩置换后的200mL烧瓶中加入500mg(0.475mmol)化合物9、141mg(0.427mmol)化合物11、甲苯32ml,形成均匀的溶液。将所得甲苯溶液用氩鼓泡30分钟。然后,向甲苯溶液中加入三(二亚苄基丙酮)二钯6.52mg(0.007mmol)、三(2-甲苯甲酰)膦(tris(2-toluyl)phosphine)13.0mg,在100℃下搅拌6小时。然后,向反应液中加入溴化苯500mg,进一步搅拌5小时。然后,将烧瓶冷却到25℃,将反应液注入甲醇300mL中。过滤所析出的聚合物而获得,将所得聚合物放入圆筒滤纸中,使用索氏提取器,用甲醇、丙酮及己烷分别提取5小时。将圆筒滤纸内残留的聚合物溶解于甲苯100mL中,加入二乙基二硫代氨基甲酸钠2g和水40mL,回流下搅拌8小时。除去水层后,将有机层依次用水50ml洗涤2次、用3wt%的醋酸水溶液50mL洗涤2次、用水50mL洗涤2次、用5%氟化钾水溶液50mL洗涤2次、用水50mL洗涤2次,将所得溶液注入甲醇,使聚合物析出。过滤聚合物后,干燥,将所得聚合物再次溶解于邻二氯苯50mL,通入氧化铝/硅胶柱。将溶出液注入甲醇,使聚合物析出,过滤聚合物后,干燥,获得精制后的聚合物185mg。以下,将该聚合物称为高分子化合物A。高分子化合物A的聚苯乙烯换算的重均分子量为29000,聚苯乙烯换算的数均分子量为14000。高分子化合物A的光吸收端波长为890nm。高分子化合物A的最高被占轨道的能量的绝对值为5.14eV。
高分子化合物A具有下述重复单元。式中,n表示重复单元数。
实施例1
(有机光电转换元件的制作)
将使利用溅射法成膜而得的约150nm膜厚的ITO进行图案化后的玻璃基板,用有机溶剂、碱性洗剂、及超纯水进行洗涤,使其干燥。使用紫外线臭氧(UV-O3)装置,对该玻璃基板实施紫外线臭氧(UV-O3)处理。
用孔径0.5μm的过滤器过滤使聚(3,4)乙烯二氧噻吩/聚苯乙烯磺酸溶解于水而成的悬浊液(HC STARCK B-TECH CO.制、Bytron P TP AI 4083)。将过滤后的悬浊液旋涂到基板的ITO侧而以70nm的厚度成膜。接着,在大气中,在热板上在200℃下使其干燥10分钟,形成有机层。
接着,将邻二氯苯30ml放入玻璃制的试样瓶中,在氧浓度1%以下的手套箱中使其静置。手套箱中的氧检测器的监测值显示为0%。实施了如下所述的第一脱氧处理:在邻二氯苯中放入玻璃制的抽水管,借助该抽水管流入30分钟氮,在溶剂中使氮鼓泡。然后,将[6,6]-苯基C71-丁酸甲酯([6,6]-Phenyl C71 butyric acid methyl ester)和高分子化合物A,按照高分子化合物A的重量相对于[6,6]-苯基C71-丁酸甲酯的重量之比为2的方式,添加到邻二氯苯中,制作涂布液。高分子化合物A的重量相对于该涂布液的重量为0.5重量%。然后,将涂布液在140℃下加热搅拌。实施了如下所述的第二脱氧处理:加热搅拌时,在涂布液中放入玻璃制的抽水管,借助该抽水管流入30分钟氮,在溶液中使氮鼓泡。此时的氧浓度为3.8ppm。
在第二脱氧处理后的涂布液中投入搅拌子(stirrer chip),以300rpm至1000rpm的转速进行搅拌。搅拌在带有可变温度功能的热搅拌器上进行,使设定温度为140℃。然后,用孔径0.5μm的过滤器对涂布液进行过滤,将所得滤液旋涂到该有机层上,然后在氮气氛中进行干燥,形成活性层。
将从SIGMAS ALDRICH公司购入的Titanium(IV)isopropoxide97%,按照1重量(wt)%的浓度,混合到异丙醇中,将所得溶液旋涂到该活性层上,以10nm的膜厚进行制膜,接着,将Al以约70nm的膜厚进行成膜,形成电极。接着,通过将环氧树脂(快速固化型Araldite(商品名))用作密封材料来粘接玻璃基板,由此实施密封处理,获得有机薄膜太阳能电池。
实施例2
(有机光电转换元件的制作)
除了实施如下所述的第三脱氧处理以外,按照与实施例1相同的方法制作有机光电转换元件,所述第三脱氧处理如下:在搅拌第二脱氧处理后的涂布液时,在该涂布液中放入玻璃制的抽水管,借助该抽水管流入氮30分钟,在液体中使氮鼓泡。此时的涂布液的氧浓度为0.8ppm。
比较例1
(有机光电转换元件的制作)
除了不进行第一脱氧处理及第二脱氧处理以外,按照与实施例1相同的方法制作有机光电转换元件。此时所用的涂布液的氧浓度为25.2ppm。
(光电转换效率的评价)
实施例1、实施例2及比较例1中获得的有机光电转换元件即有机薄膜太阳能电池的形状为2mm×2mm的正方形。使用太阳模拟器(分光计器制、商品名:CEP-2000型、放射照度100mW/cm2),对这些有机薄膜太阳能电池照射一定的光,测定产生的电流和电压,算出光电转换效率。结果示于表1。
[表1]
产业上的可利用性
根据本发明的制造方法,能够制造光电转换效率优异的有机光电转换元件,因此本发明是有用的。
有机光电转换元件的制造方法专利购买费用说明
![]()
Q:办理专利转让的流程及所需资料
A:专利权人变更需要办理著录项目变更手续,有代理机构的,变更手续应当由代理机构办理。
1:专利变更应当使用专利局统一制作的“著录项目变更申报书”提出。
2:按规定缴纳著录项目变更手续费。
3:同时提交相关证明文件原件。
4:专利权转移的,变更后的专利权人委托新专利代理机构的,应当提交变更后的全体专利申请人签字或者盖章的委托书。
Q:专利著录项目变更费用如何缴交
A:(1)直接到国家知识产权局受理大厅收费窗口缴纳,(2)通过代办处缴纳,(3)通过邮局或者银行汇款,更多缴纳方式
Q:专利转让变更,多久能出结果
A:著录项目变更请求书递交后,一般1-2个月左右就会收到通知,国家知识产权局会下达《转让手续合格通知书》。
动态评分
0.0